[3차펀딩] 합성 생물학 기반의 신규 항생제 기술 기업, ㈜리신바이오
사전예약에 참여하시면 프로젝트 시작 오픈
소식을 카카오알림톡으로 알려드립니다.
증권 발행 조건
| 증권종류 |
전환사채
 만기에 원금을 상환받을 수 있는 상환권과 투자 후 일정기간 이후부터 주식으로 전환할 수 있는 보통주 전환권을 가진 하이브리드형 투자상품으로 원금 상환의 안정성과 주식 전환의 수익성을 동시에 추구할 수 있어 투자자에게 유리한 투자방식입니다.
만기에 원금을 상환받을 수 있는 상환권과 투자 후 일정기간 이후부터 주식으로 전환할 수 있는 보통주 전환권을 가진 하이브리드형 투자상품으로 원금 상환의 안정성과 주식 전환의 수익성을 동시에 추구할 수 있어 투자자에게 유리한 투자방식입니다.
|
목표금액 | 50,004,000원 |
|---|---|---|---|
| 1구좌당 금액 | 9,000원 | 투자가능 최소수량 | 50구좌 |
| 발행예정 구좌수 | 5,556구좌 | 만기일 | 2029. 03. 20 |
|
전환청구기간
 투자자가 채권을 주식으로 전환할 수 있는 기간(발행일로부터 6개월 후-만기일 기준 5영업일 전)으로, 전환청구 기간은 프로젝트별 발행기업에 따라 다를 수 있음
투자자가 채권을 주식으로 전환할 수 있는 기간(발행일로부터 6개월 후-만기일 기준 5영업일 전)으로, 전환청구 기간은 프로젝트별 발행기업에 따라 다를 수 있음
|
2026. 09. 20 ~ 2029. 03. 13 |
1주당 전환가액
 주식으로 전환할 시에 적용하는 주식의 가격입니다.
주식으로 전환할 시에 적용하는 주식의 가격입니다.
|
9,000원 |
| 연 이자율 | 7% | 청약기간 | 2026. 02. 24 ~ 2026. 03. 10 |
| 이자 지급주기 | 3개월 | 배정일 | 2026. 03. 19 |
| 배정방법 | 목표금액 내 선착순 배정 | 납입일 | 2026. 03. 20 |
| 명의개서 대리인 | 한국예탁결제원 | 발행일 | 2026. 03. 20 |
| 청약증거금 예치기관 | 신한은행 | 증권 입고일 | 2026. 03. 20 |
| 비고 | · 기업가치(Pre-money Valuation) : 11,356,695,000원 ( ☞기업가치 산정 근거 바로 가기 ) | ||
· 배정방법(목표금액 내 선착순 배정)에 따라 미배정 또는 일부 배정이 될 수 있으며, 배정되지 않은 청약금은 투자예치금 계좌로 환불(2026.03.18)됩니다.
· 상기 모집정보는 프로젝트 오픈 시 변경될 수 있습니다.
투자포인트
- POINT 1합성 생물학 기반 단백질 신약 개발 기술(CMic)과 세계 최초 eLBP 기반 경구용 항생제 개발 기술(eLBP) 등 확장성 높은 플랫폼 기술 보유
- POINT 2비임상 단계에서 국내 제약사와 글로벌 빅파마로의 기술이전을 통한 수익 창출 및 IPO 추진 계획
(IPO 목표로 IBK증권 주관사 계약 체결) - POINT 3대한뉴팜(주)과의 전략적 제휴(지분투자, 공동연구, 마케팅)를 통해 박테리오파지를 적용한 가축 대상의 가금티푸스 예방 기능의 보조사료(항생제 대체제 기능) 생산 및 판매 시작
(항생제 대체제 개발은 진행 중이며, 추후 대상 품목 확대 예정) - POINT 4벤처인증기업으로 투자금액 전액 소득공제 가능
소득공제 · 이자계산기
연소득(과세표준)
원
투자금액
원
소득공제
|
소득공제액
 소득 공제율
소득 공제율3천만 원 이하 100% 3천만 원 초과 5천만 원 이하 70% 5천만 원 초과 30% |
0원 (투자금액의 0%) |
|
|---|---|---|
| 공제 전 | 공제 후 | |
| 과세표준 | 0원 | 0원 |
| 소득세액 | 0원 | 0원 |
| 절세금액 | 0원 | |
실질 수익(예상)
-
소득공제 혜택 (지방소득세 포함)
0원
-
이자(연 7%, 36개월)
0원
-
총 수익
0원
-
투자금액 대비 수익률
0%
·소득공제 혜택은 소득의 유형(근로소득, 사업소득), 공제 항목 등에 따라 달라질 수 있습니다.
·이자는 이자소득세(15.4%) 원천징수 후 지급됩니다.
· 2023년 1월 1일자 소득세법 개정으로 '소득세 과세표준 구간'이 조정되었습니다.
투자핵심노트

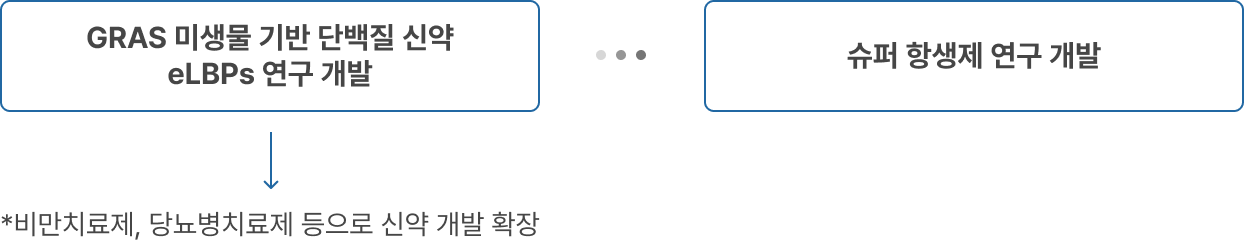
GRAS 미생물 기반 단백질 신약 eLBPs 및 슈퍼 항생제 개발로
바이오산업의 새로운 패러다임을 실현하겠습니다.
2020년 10월 설립한 ㈜리신바이오는 높은 수준의 분자생물학적 기술을 바탕으로 항생제 내성(AntiMicrobial Resistance, AMR) 감염병의 위협에 대응하기 위하여 재조합 엔도라이신 플랫폼과 eLBPs 플랫폼의 상호 유기적인 합성생물학 기반 연구 개발을 통해 슈퍼 박테리아 감염 치료제를 연구개발하고 있는 바이오 벤처 기업입니다.
현재 동물 및 사람에게 치명적으로 작용하는 세균들을 타겟으로 GRAS(generally regarded as safe, 일반적으로 안전하다고 볼 수 있는 물질) strains DDS(Drug Delivery System, 약물이 체내에 전달되는 시스템) 기반 경구용 장내 세균성 감염 치료제 eLBPs와 Endolysin 기반 IV용 슈퍼 박테리아 감염 치료제 연구 개발을 진행하고 있습니다.
현재 인류는 1970년대 중반 이후 항생제 내성균 처치를 위한 신규 슈퍼 항생제 개발이 전무한 실정이며 2020년부터 몇 년간 지속된 코로나19 펜데믹을 통해 감염병의 위험성을 절감하고 있는 상황입니다. 세계보건기구(WHO)가 꼽은 ‘인류가 직면한 세계 10대 공중보건 위협’ 중 하나인 AMR은 세균이 균을 억제하거나 죽이기 위해 만들어진 약물 등에 노출됐음에도 죽지 않고 살아남는다고 해서 ‘제2의 암’이라고도 불립니다. 박테리아, 바이러스, 곰팡이나 기생충 등이 더는 약물에 반응하지 않아 감염 치료가 불가능해지고 심각할 경우 질병 확산, 사망자 급증 등의 문제로 확산할 위험이 있습니다. 2016년 영국 ‘Welcome Trust Foundation’의 보고서 「The review on antimicrobial resistance」는 2050년, 전 세계가 감염병으로 인해 암을 뛰어 넘는 1,000만 명의 사망자와 11경 원에 이르는 경제적 손실이 발생할 것이라고 경고한 바 있습니다.
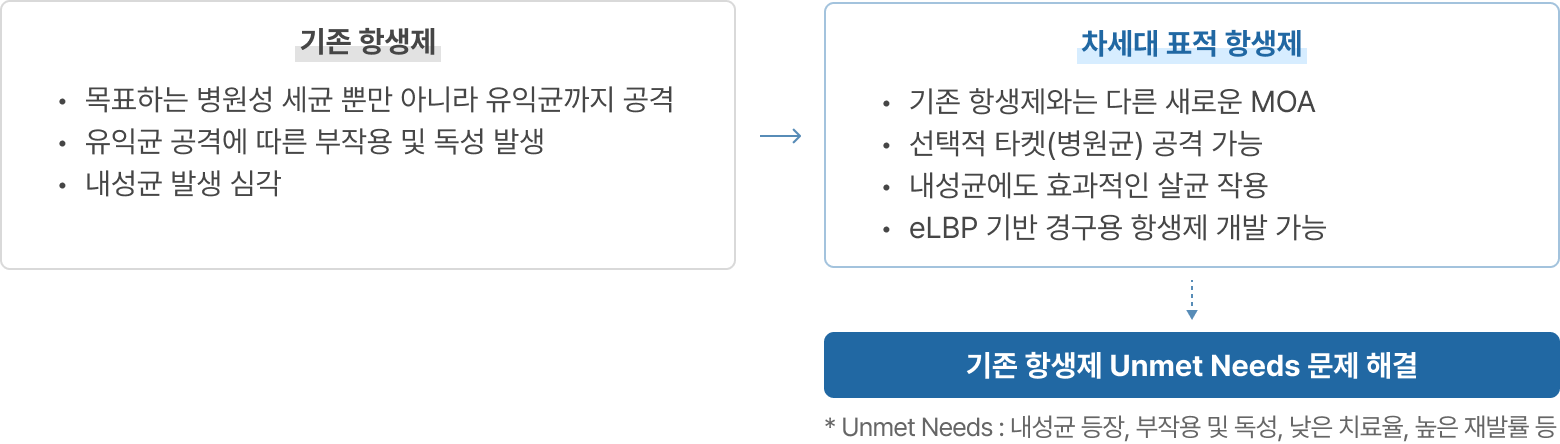
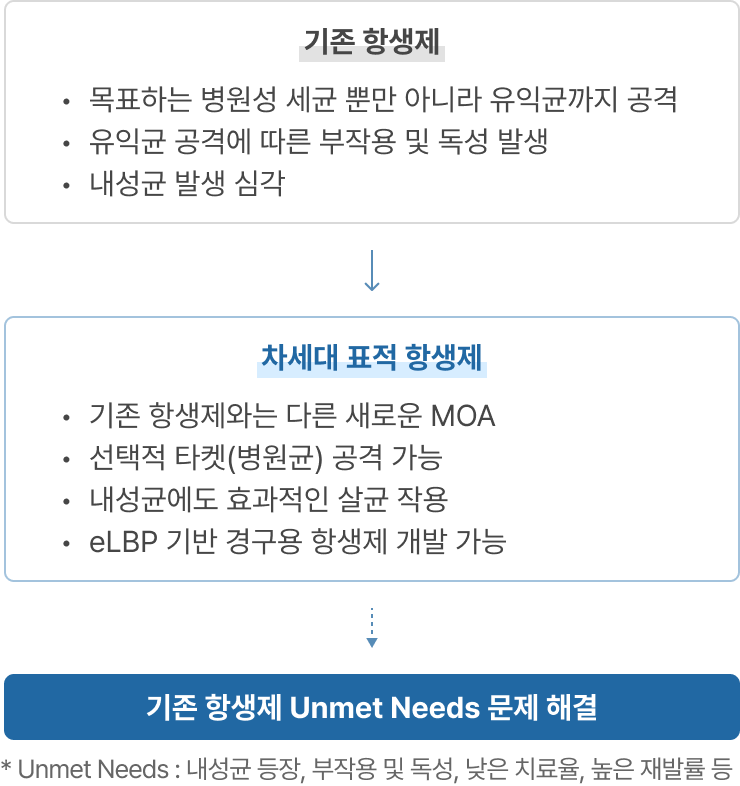
이처럼 기존 화학 합성 항생제들이 갖는 작용기작과는 전혀 다른 작용기작의 새로운 항생제가 필요한 상황임에도 불구하고 1900년 이후 FDA로부터 승인된 항생제 총 164개 중 최근 35년간 신규 타겟으로 승인된 항생제는 단 1개(2012년 ATP 합성효소 저해제 Bedaquiline 결핵 감염에 대해 FDA 승인 획득)뿐입니다. 이에 따라 최근 글로벌 시장에서 빅파마들의 항생제 개발을 향한 경쟁이 뜨겁게 펼쳐지고 있는 상황입니다. 그 예로 2013년 항생제 개발 전문회사인 트리어스(Trius Therapeutics)와 옵티머(OptimerPharmaceuticals)를 큐비스트(Cubist)가 인수 하였고, 2014년에는 빅파마인 악타비스(Actavis, 현재 Allergan)가 포레스트랩(Forest Labs)과 듀라타(DurataTherapeutics)를 인수, 2015년 1월에는 글로벌 제약사 머크(Merck & Co)가 항생제 개발 전문회사인 큐비스트를 95억 달러에 인수하였습니다.
리신바이오는 기존 항생제의 Unmet Needs(미충족 욕구- 내성균 등장, 부작용 및 독성, 낮은 치료율, 재발률 등) 해결을 위한 글로벌 ‘차세대 항생제 개발 현황’에 주목하고 재조합 엔도라이신 플랫폼과 eLBPs 플랫폼의 상호 유기적인 합성생물학 기반 연구를 통해 슈퍼 박테리아 감염 치료제를 개발해오고 있습니다.
리신바이오는 합성 생물학 기반 단백질 신약 개발 기술(eLBPs)과 세계 최초 eLBP 기반 경구용 항생제 개발 기술(CMic) 등 확장성 높은 플랫폼 기술을 보유하고 있습니다. 합성 생물학 기반의 재조합 단백질 생산기술을 통해 다재내성균과 그람 음성균 처치용 항생제를 개발하고 있으며, eLBPs 플랫폼 기술 영역에서는 가금티푸스를 포함한 가축용 항생제 대체제 개발과 전문약이 없는 난치성 병원균 치료제, GLP-1 기반 항비만, 항당뇨 치료제를 개발하고 있습니다.
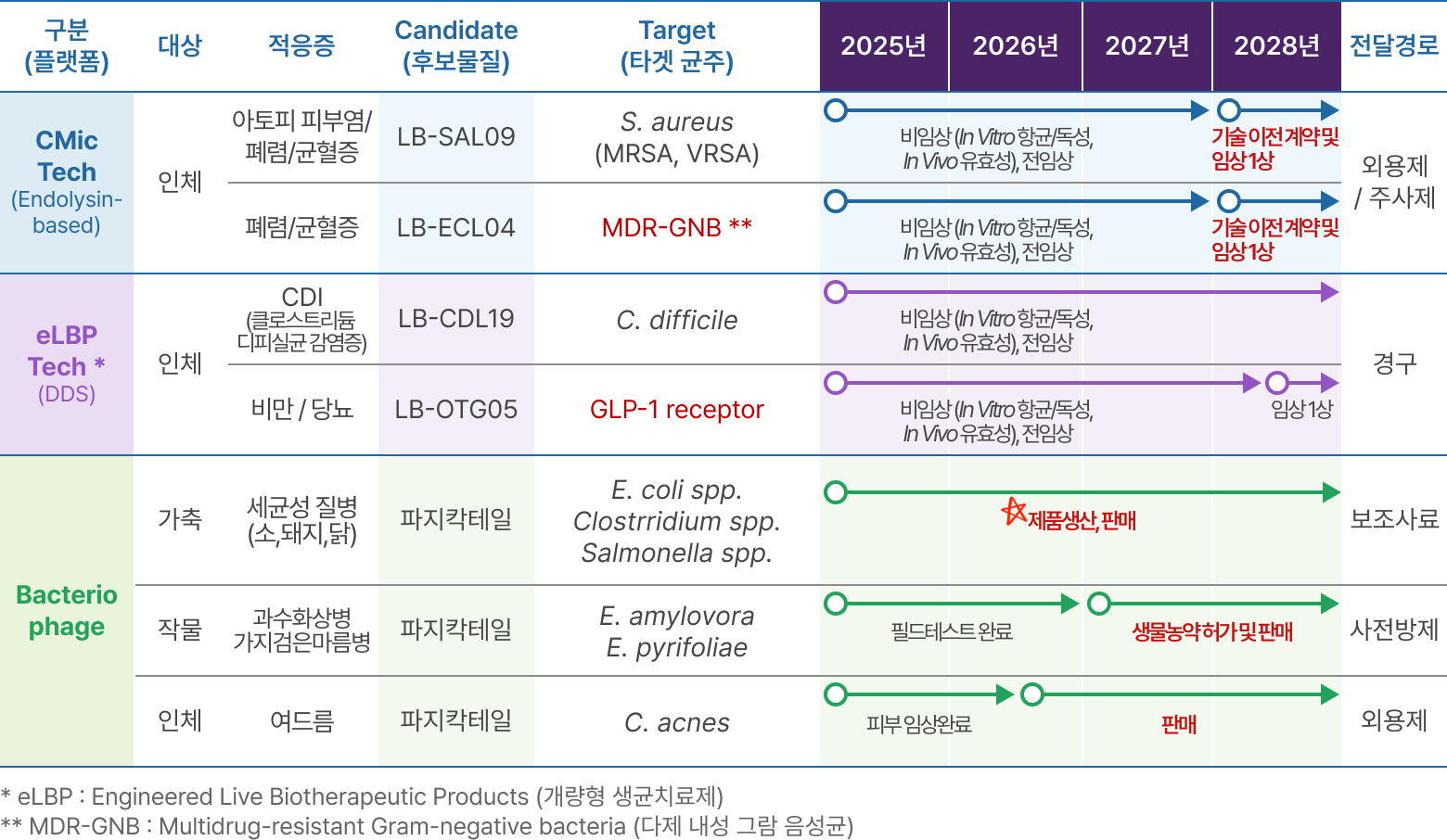
❶ eLBPs Tech
리신바이오가 합성 생물학 기반 단백질 신약 기술로 현재 개발 중인 적응증은 CDI, 가금티푸스, 비만 치료제 등이 있습니다.
CDI(장내 질병 관여균) 경우, 장내 세균 C. difficile에 대한 기존 치료법인 메트로니다졸, 반코마이신 등 항생제 투약은 고독성(hypervirulent) 균주에 의한 난치성 중증 CDI(장내 질병 관여균) 치료 및 CDI의 재발 치료(재발 반복)는 어려워 2022년 12월, 세계 최초로 마이크로바이옴 치료제 레비요타(스위스 페링제약, 분변 이식 기술 기반)가 미국 FDA 승인을 받았으며. 이후 국내외 마이크로바이옴 산업은 급성장하고 있으나 현재 CDI, 궤양성대장염 등의 마이크로바이옴 치료제는 프로바이오틱스 투여 및 대변 이식 등 숙주의 미생물을 조절하는 일부 기술이 적용되어 심각한 부작용 유발 가능성이 있습니다.
박테리오파지 유래 리신단백질을 이용한 치료제 개발을 진행 중인 국내·외 경쟁업체들의 경우 리신단백질을 재조합 균주로부터 발현시켜 분리·정제하고 이를 주사제 혹은 신체에 도포하는 외형제 형태의 의약품 개발에 집중하고 있는 상황입니다. 리신바이오 역시 동일한 기술로서 주사제, 외형제 형태의 단백질 기반 의약품 개발을 진행하고 있으며 이와 함께 장내에서 문제를 일으키는 다양한 병원균들의 치료를 위한 경구제 형태의 치료제 개발을 진행하고 있습니다. 그러나 여기서 주목할 점은 리신바이오의 가장 큰 차별성이라 할 수 있는, 타겟하는 세균에 대응하는 박테리오파지 유래 lytic 효소인 재조합 리신단백질을 장내에서 유익한 활동을 하는 프로바이오틱스(probiotics) 균주의 표면에 디스플레이 하거나 혹은 분비할 수 있게 제작하는 기술이며 최종 제작된 재조합 균주를 직접 경구로 투여할 수 있는 약물로 개발하고자 하는 것입니다. 이는 가축 및 인간의 장내 세균성 감염을 직접적으로 치료할 수 있는 living medicine으로서 국내는 물론 세계 최초로 개발을 진행하고 있습니다.
현재 리신바이오가 연구개발 중인 CDI(장내 질병 관여균) 치료제 ‘LB-CDL19’는 eLBPs(Engineered Live Biotherapeutics Products) 기반 정확한 작용기전을 갖는 경구용 치료제입니다. eLBPs는 반복적 투약 및 주사가 불필요한 차세대 마이크로바이옴 고도화 기술이 적용된 것으로 기존 치료제의 부작용은 물론 환자의 비용 절감 또한 현저하게 낮출 것으로 기대되고 있습니다.
동물 대상의 가금티푸스 치료제 ‘LB-SGL’은 S. gallinarum 처치를 위한 항생제 대체제로, S. gallinarum을 감염시킨 실험군을 대상으로 Endolysin secretion system을 섭취한 실험군에서 기존 항생제 처리 실험군과 유사한 생존율, 증체량, 세균수 감소, 장기 크기 불변 등을 확인하였습니다.
이러한 연구 개발 성과에 힘입어 국내 상장 제약회사인 대한뉴팜(주)과 투자 및 공동연구, 제품 생산을 포함한 전략적 제휴를 체결하였습니다(2024년 12월). 대한뉴팜과의 제휴를 통해 가금티푸스(조류) 예방용 항생제 대체제와 가금류 병원성 원인균인 살모넬라를 타겟으로 한 육계, 오리, 산란, 중계용 보조사료 원료(박테리오파지 부분 참조)를 생산하기로 하였습니다(2025년 공장 확보). 생산된 제품은 대한뉴팜(주)을 통해 국내 시장에 판매되며, 항생제 대체제와 보조사료는 추후 양돈, 축우용 제품으로 확대할 계획입니다. 또한 싱가포르 제약회사인 자이로닉스와 전략적 제휴를 체결하고 리신바이오의 eLBP 기반의 축산용 항생제 대체제의 공동연구와 마케팅을 진행하기로 하였습니다. 현재 자이로닉스 측에서 리신바이오의 가금티푸스 제품 생산 관련하여 멕스코의 Bachoco사 및 브라질 BRF사에 제안한 상태로 성사될 경우 해외 진출의 교두보가 마련될 것으로 보입니다.
인체 대상의 비만치료제 ‘LB-OTG05’는 당사 플랫폼기술 eLBPsystem을 적용하여 특허분쟁이 없는 GLP-1 유사체인 Exenatide를 발현하는 GRAS 미생물을 개발, 경구용 비만치료제로 접근하였다는 점에서 국내 제약사와의 차별성이 있습니다. 쥐 대상의 실험 결과, 세포 발현 후 12주차에 약 11% 체중 감소 및 12% 혈당 감소가 나타난 것을 확인하였습니다.
❷ CMic Tech
CMic(맞춤형 엔도라이신 선별 기술)을 적용하여 엔도라이신 기반 IV용 슈퍼박테리아 감염 치료제 개발을 위한 연구를 진행하고 있습니다.
리신바이오가 현재 CMic 기술을 활용하여 연구 개발 중인 치료제는 ‘LB-SAL09’와 ‘LB-ECL04’가 있습니다.
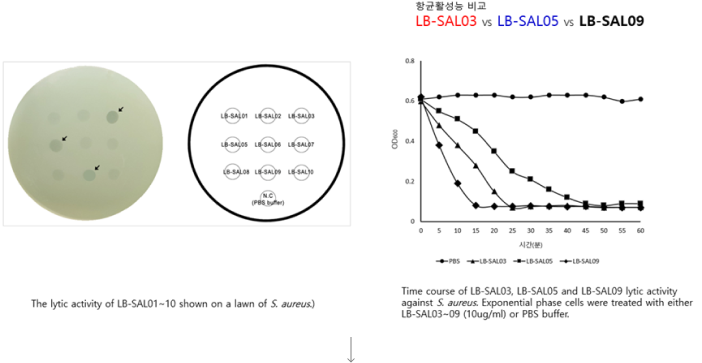
‘LB-SAL09’는 화농성 염증, 중이염, 폐렴, 수술 후 창상 감염, 식중독 등을 일으키는 원인균인 S. aureus(황색포도상균)을 치료하는 기존 항생제의 내성균 MRSA, VRSA 감염증의 치료제입니다. MRSA는 메치실린계저항성 세균 황색포도상구균으로 개방된 상처가 있거나 면역체계가 약한 사람들의 감염 위험성이 높습니다. 또한 VRSA는 반코마이신저항성 세균 황색포도상구균으로 당뇨나 신장질환 등의 기저질환이 있을 때 위험이 높으며 중심정맥관 등을 보유하고 있을 때 반코마이신 투여 중인 사람들에게 발생 위험이 매우 높습니다. 매년 수만명의 MRSA 균혈증 환자가 발생하고 약 3,000명 이상이 사망할 정도로 매우 위험합니다. 또한 S. aureus은 아토피피부 환자에게 높은 비율로 관찰되고 있는 균으로 알려져 있습니다. 치료제 실험 결과 S. aureus 전신감염 mouse model을 이용한 LB-SAL09의 유효성 확인하였고, 도메인 셔플링 신규 엔도라이신 확보 실험에서도 Recombinant PCR을 통한 신규 Endolysin(LB-SAL00) 유전자를 확보하였습니다. 주사제로 개발하기 위한 세포 독성과 적혈구에 미치는 영향 실험에서도 모두 무해한 것으로 나타났습니다. 또한 환자로부터 분리한 항생제 내성 임상분리주에 대한 항균활성 실험 결과 표준균주와 내성균주에 모두 효과가 있었습니다.
‘LB-ECL04’는 그람 음성균 감염증 치료제로, 대표 다재 내성 병원균(MDR) 6가지 중 ‘다제 내성 아시네토바우마니 감염증’은 카바페넴계, 아미노글리코사이드계, 플로로퀴놀론계 항생제 내성균으로 제4급 법정감염병으로 분류되며, 전세계적으로 증가 추세에 있고 특히 국내 슈퍼박테리아 사망 원인 중 1위에 해당될 정도로 점차 그 심각성이 우려되고 있습니다.
‘그람 음성균’은 ‘그람 양성균’과 달리 내독소(Endotoxin)로 작용하는 세포 외막(outer membrane)이 존재하기 때문에 그람 음성균의 외막을 통과할 수 있고, 그람 음성균 사멸 시 방출하는 내독소를 중화할 수 있는 전략이 필요합니다.
또한 ‘LB-ECL04’는 장출혈성 대장균(EHEC) 감염증 치료제로 개발 중입니다. EHEC는 독소를 생성하는 장출혈성 대장균 감염에 의하여 출혈성 장염을 일으키는 질환으로 용혈성 요독증후군(HUS)과 같은 합병증을 일으키는데 5세 이하 어린이의 경우 HUS 진행 시 치명률이 매우 높습니다. EHEC 처지를 위한 eLBP system 개발 실험 결과, Endolysin secretion system을 섭취한 실험군에서 기존 항생제 섭취 실험군 이상의 생존율을 확인하였으며, 분변 내 세균이 검출되지 않았으며, 체중 증가, 간과 비장의 중량 불변 등을 확인할 수 있었습니다.
리신바이오의 endolysin 유전자 서열을 기반으로 한 신규 재조합 endoysin 연구 실험 결과, 모두 개발 물질은 유해균에는 효과를 보이지만, 장내 다른 유익균에는 영향을 미치지 않았으며, 주사제로 개발하기 위한 세포 독성과 적혈구에 미치는 영향 실험에서도 모두 무해한 것으로 나타났습니다.
❸ 박테리오파지(Bacteriophage)
리신바이오가 박테리오파지 기반으로 현재 개발 중인 적응증은 동물 대상의 가금티푸스, 작물 대상의 바이오농약, 사람 대상의 여드름 치료제가 있습니다.
동물 대상의 가금티푸스 치료제는 가금류 병원성 원인균 살모넬라(S. gallinarum, S. typhimurium, S. enteritidis)을 대상으로 항생제 대체제(‘LB-SGL’- eLBPs 기술)와 보조사료 형태(박테리오파지)로 개발이 진행되고 있습니다. 특히 박테리오파지를 적용한 보조사료는 2025년에 육계, 오리, 산란, 중계용 보조사료 원료 형태로 사업화하였으며 현재 생산이 시작되어 2026년 2월부터 매출이 발생하고 있습니다(월 매출 1500만원 예상 / 점차 양돈, 축우용 제품으로 확대 예정).
당초 가금티푸스 치료제는 합성 생물학 기반 단백질 신약 기술(eLBPs)을 적용한 항생제 대제제를 바로 개발할 계획이었으나, 대한뉴팜 측의 요청으로 1차 시장 진입은 박테리오파지를 이용한 제품으로 진행하고 향후 제품의 업그레이드가 필요하면 연장선에서 eLBPs로 적용하기로 하였습니다(박테리오파지와 eLBPs 모두 적용 대상 동물은 동일). 박테리오파지는 허가 사항 때문에 보조사료 형태로 판매되지만, 실제 적용은 항생제 대체제 예방용으로 사용됩니다.
또한 현재 화학 농약의 한계를 극복하고 병을 선제적으로 예방할 수 있는 박테리오파지 기반의 바이오농약 개발과 함께 여드름 원인균 관련한 박테리오파지 연구도 진행하고 있습니다. 여드름 치료를 위한 안전하고 효과적인 항생제 대체제로서 박테리오파지 기반의 제품도 개발할 예정입니다.
리신바이오는 원천 기술에 대한 특허 보호, 파이프라인별 지식재산권 확보로 높은 진입장벽을 구축하고 있습니다(현재까지 특허등록 3건, 도입 특허 1건, PCT 출원 1건, 특허출원 2건).
이와 함께 연구개발 능력을 인정받아 중소벤처기업부 주관의 국책과제 3개에(TIPS, BIG3, TIPS 창업화사업)에 선정되어 각각 5억원, 5.7억원, 0.7억원을 지원받고 연구과제를 진행하였으며(과제 모두 성공적으로 완료)하였으며, 2023년 6월에는 중소벤처기업진흥공단(중진공)으로부터 '성장공유형 자금'을 투자 유치에 성공하였습니다. '성장공유형 자금'은 우수한 기술력과 사업성을 보유한 유망 중소벤처 기업 중 기업공개(IPO) 가능성이 높은 기업을 대상으로 투자를 진행하는 사업입니다. 현재 파이프라인별 효능 및 안정성을 확인한 리드물질을 확보한 단계로서 이번 중진공 성장공유형 자금 투자 유치를 통해 내년 2건 이상의 전임상 시험을 차질없이 준비할 계획입니다. 또한 국내 TCB인 NICE평가정보(주)의 기술평가 심사에서 ‘합성생물학 기반 경구용 단백질 신약개발 기술’에 대하여 T-5 우수 등급을 받아 '2023년 기술평가 우수기업'으로 인증 받았으며, 한국기술신용평가(주)의 기술평가 심사에서도 ‘합성생물학 기반 경구용 단백질 신약개발 기술’에 대하여 T-5 우수등급을 받아 ‘2024년 기술평가 우수기업’으로 인증받았습니다.
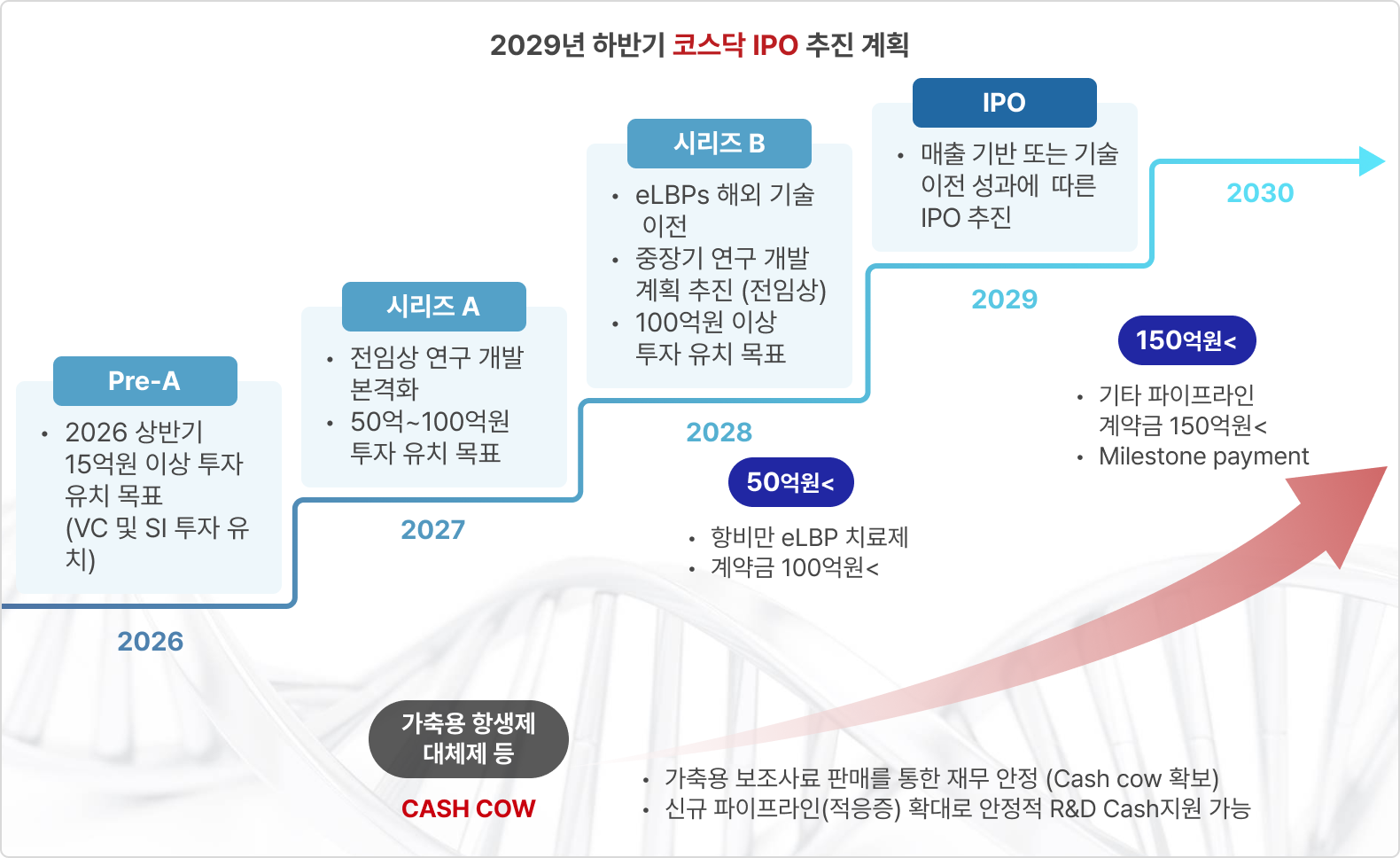
리신바이오의 수익창출 전략은, 기초연구부터 의약품 승인까지 모든 과정을 진행하는 전통적인 제약 기업과 달리 비임상 단계부터 국내 제약사 또는 글로벌 빅파마로의 기술이전을 통한 수익을 창출하는 것입니다. 이 중 eLBPs 치료제의 기술 이전은 eLBPs의 인허가가 상대적으로 용이한 해외기업을 대상으로 접촉할 계획입니다.
바이오 기술 이전은 신약 후보물질·개발기술을 글로벌 제약사에 이전하고 계약금·마일스톤·로열티를 받는 거래로서, 2023년 국내 제약·바이오기술 수출은 18건, 6조6,326억원 규모였으며 최근 5년간 국내 기술이전은 104건, 계약금 48조원 규모입니다. 특히 글로벌 빅파마는 임상단계 후보물질 도입을 선호해 계약금·마일스톤 규모가 커지는 추세입니다.
리신바이오는 eLBPs와 CMic 파이프라인의 단계별 성과를 바탕으로 기술 이전 성과에 따른 IPO 추진을 위해 IBK투자증권(주)과 코스닥 상장 대표주관계약을 체결하였습니다(2023년 5월). 이번 계약을 통해 IBK투자증권(주)은 대표주관회사로서 리신바이오의 코스닥 시장 상장 준비를 위해 경영 관리, 재무 회계 및 세무 관리, 코스닥시장 상장규정에 의한 상장 요건 충족 여부 등에 대한 점검 및 자문 업무를 수행해나갈 계획입니다.
또한 기술 이전까지의 사업구조가 약한 R&D 회사의 어려움을 극복하기 위해 정부 연구과제 수행 외에 인체용 신규 항생제 개발과 더불어 빠른 시장 진입이 가능한 가축대상 항생제 대체제, 보조사료(미생물제), 유기태, 당사 플랫폼 기반 기능성 화장품 등의 개발 및 사업화를 진행 중이며 이를 통해 기술 이전 성과에 따른 IPO 추진 전까지 안정적인 캐시카우를 확보해나갈 계획입니다.
리신바이오는 차세대 표적 항생제를 개발하여 기존 항생제 Unmet Needs 시장에서 플랫폼 기반 First-in-class 신약 개발 전문기업으로 성장해나갈 것입니다.
비전 및 목표
비전
플랫폼 기반 First-in-class 신약개발 전문기업
목표
차세대 표적 항생제 개발로
기존 항생제 Unmet Needs(미충족 수요) 시장 GLOBAL 1위 기업
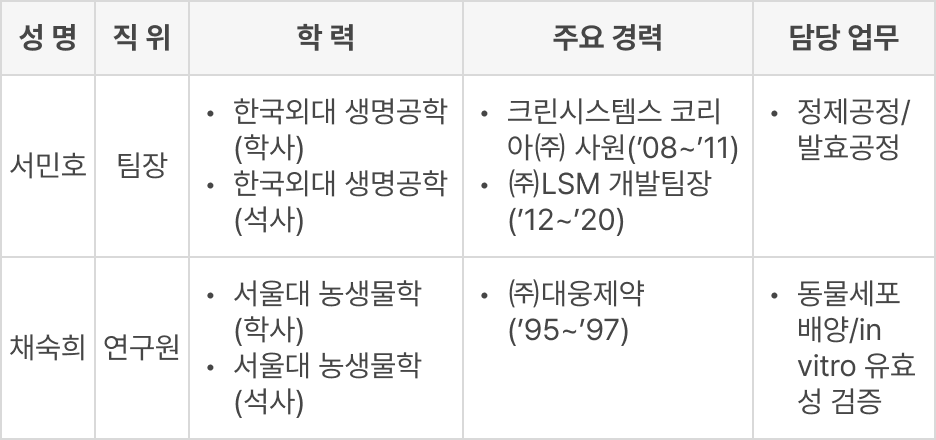
조직 소개
조직도
경영진


연구인력

사업 영역
의학 및 약학 연구 개발
 동물 및 사람에게 치명적으로 작용하는 세균들을 타겟으로 ❶ GRAS(generally regarded as safe) strains DDS 기반 경구용 장내 세균성 감염 치료제 eLBPs와 ❷ Endolysin 기반 IV용 슈퍼 박테리아 감염 치료제 개발을 위한 연구 진행
동물 및 사람에게 치명적으로 작용하는 세균들을 타겟으로 ❶ GRAS(generally regarded as safe) strains DDS 기반 경구용 장내 세균성 감염 치료제 eLBPs와 ❷ Endolysin 기반 IV용 슈퍼 박테리아 감염 치료제 개발을 위한 연구 진행
사업 배경
Unmet Needs 충족 가능한 차세대 항생제 개발 필요성 증대
① 항생제 내성균 문제의 심각성
- 2050년에는 암 사망자 수를 뛰어넘는 연간 1천만 명의 감염병 사망자 발생 예상
- 이에 따른 경제적 손실이 약 11경원에 이를 것으로 예상됨


항생제 개발이 항생제 내성균 문제로 한계에 봉착
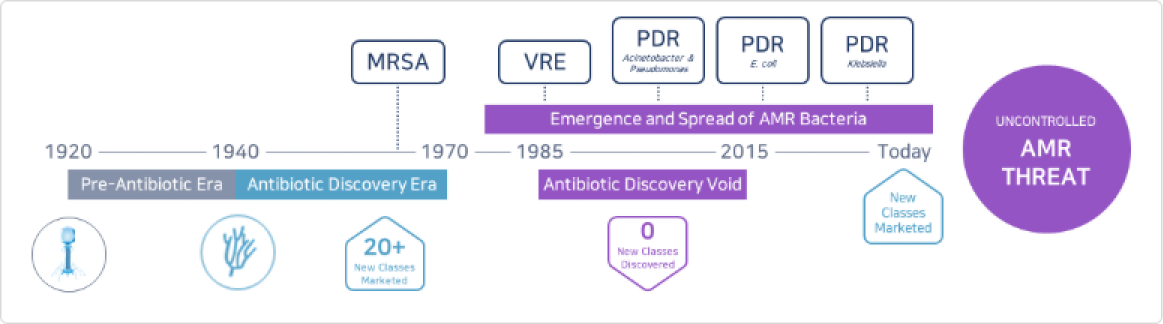


WHO, 신규 항생제 개발이 시급한 세균 12종 발표 (2017년)
|
|
* 2050년, 인류 사망 원인 분포

* 대륙별 감염병 사망자수

* 출처 : ‘The review on antimicrobial resistance’, Jim O’Neill, 2016
② 새로운 작용기작을 갖는 항생제 개발 필요
- 기존 화학 합성 항생제들의 경우 새로운 제품 출시 이후 내성균 출현시기가 점점 빨라지고 있음
- 기존 화학 합성 항생제들이 갖는 작용기작과는 전혀 다른 작용기작의 새로운 항생제가 필요한 실정임

Unmet Needs 충족 가능한 차세대 항생제 개발 현황
① 항생제 개발 현황
- 미국 질병통제예방센터(CDC)와 세계보건기구(WHO) 등은 기존 항생제의 효과 감소로 인류 생명이 위협받을 것으로 예측
- 1900년 이후 FDA으로부터 승인된 항생제 총 164개이며, 이 중 최근 35년간 신규 타겟으로 승인된 항생제는 단 1개뿐임
- 2012년 ATP 합성효소 저해제 Bedaquiline 결핵 감염에 대한 FDA 승인 획득
<1900~2019년 FDA 항생제 승인 현황>

② 기존 항생제 내성균 치료를 위한 항생제 개발 현황
- 전 세계적으로 항생제 내성균에 의한 사망자가 발생(EU 25,000명, USA 23,000명)하고 있으며 항생제 내성균 치료를 위한 개발은 많은 국가에서 진행되고 있음
<약제 내성균 치료 항생제 개발 현황>

마이크로바이옴 치료제 개발
 마이크로바이옴(microbiome)이란?
마이크로바이옴(microbiome)이란?
마이크로바이오타(microbiota)와 게놈(genome)이 합쳐서 만들어진 합성어로 인간, 동·식물, 토양, 바다, 호수, 암벽, 대기 등 모든 환경에서 서식하거나 공존하는 미생물과 그 유전정보 전체를 포함하는 미생물 공동체로 박테리아, 바이러스, 곰팡이, 고세균 등 다양한 미생물로 구성되어 있음
① 마이크로바이옴 치료제 경쟁사 R&D 현황
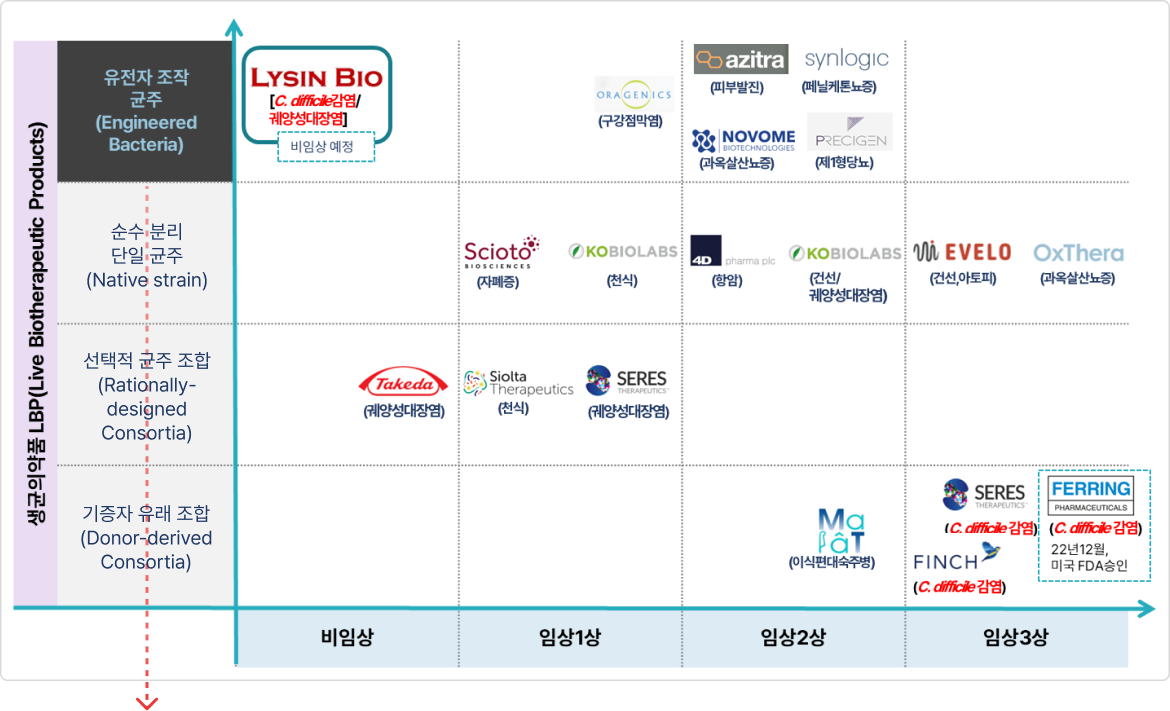
※ 유전자 조작 생균 의약품(eLBPs)
‘살아있는 의약품’이라고도 불리며, 의약품 분비 미생물 착상 시 반복적 투약 및 주사 불필요
→합성생물학의 의학 혁신 사례에 속하는 기술임
(출처: ‘합성생물학의 미래’, 과학기술정보통신부, 2023년)
② 전 세계 eLBPs 임상 현황
※ 리신바이오와 유사한 플랫폼 기술로 미국에서 진행되고 있는 현황
* 출처: Development of synthetic biotics as treatment for human diseases, 2021
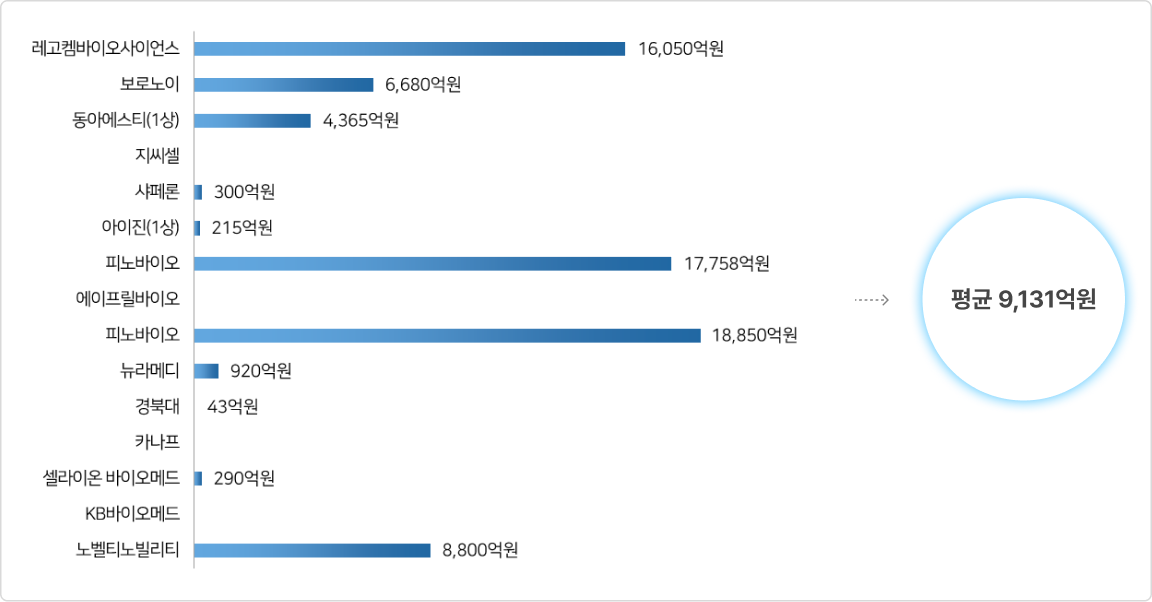
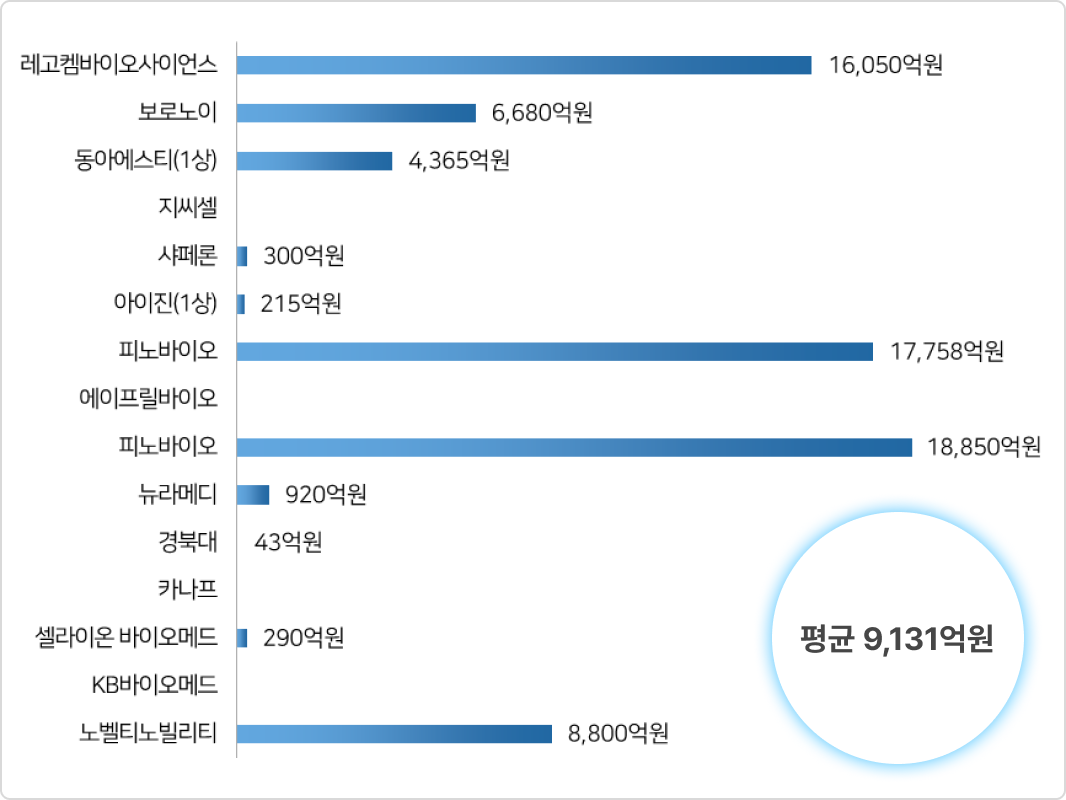
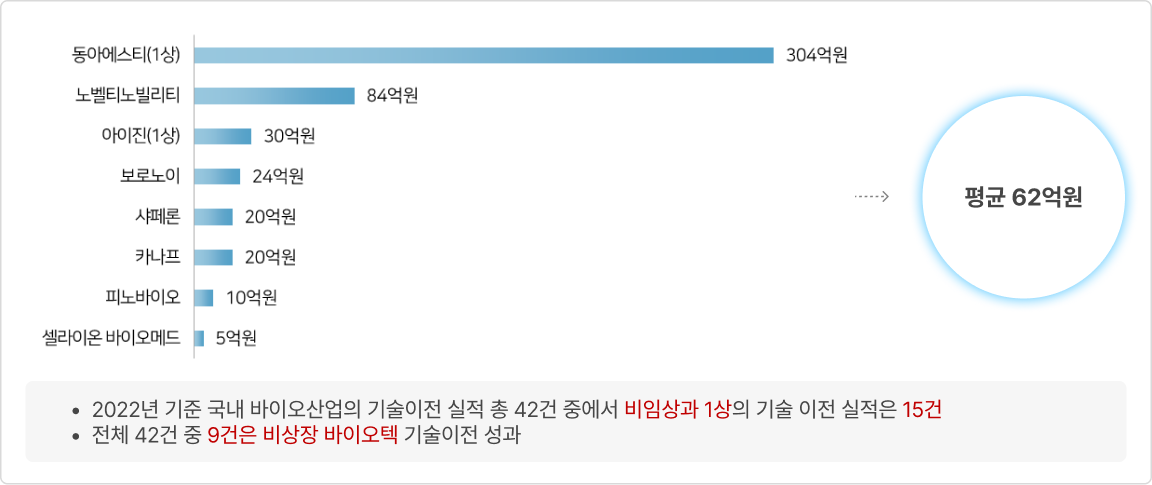
③ 국내 제약 바이오기업의 비임상 단계 기술 이전 현황(2022년)
- 2022년 제약바이오 기업(비임상~1상) 라이센스 아웃 최대 마일스톤 현황
- 2022년 제약바이오 기업(비임상~1상) 라이센스 아웃 계약금 현황(공개 8건)
* 출처: ‘바이오(신약개발 관련) Deal 정리’, 국가신약개발사업단, 2023
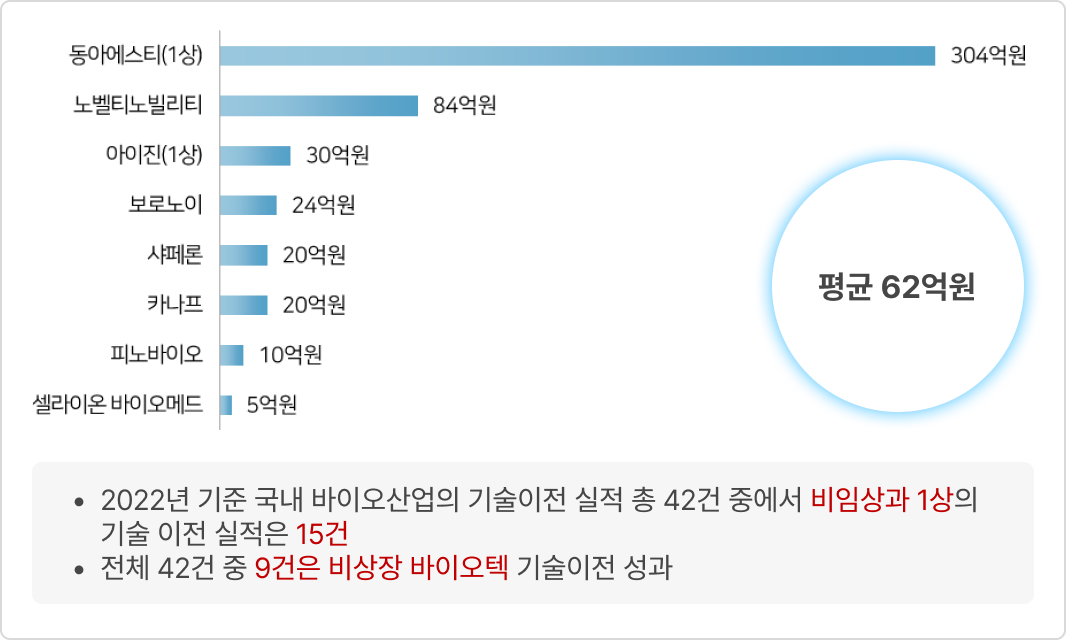
* 출처: ‘바이오(신약개발 관련) Deal 정리’, 국가신약개발사업단, 2023
④ 국가별 유전자 재조합 생균 의약품 인허가 동향
미국 FDA
* 출처: ‘국내외 마이크로바이옴 바이오의약품의 규제동향’, 배진우, 2020 |
유럽 EMA
* 출처: ‘국내외 마이크로바이옴 바이오의약품의 규제동향’, 배진우, 2020 |
국내 식약처
* 출처: ‘생균치료제의 임상시험시 품질 가이드라인(민원인 안내서)’, 식품의약품안전평가원, 2022 |
⇣
|
비임상 준비 단계부터 식약처와 사전 조율 |
기술 경쟁력
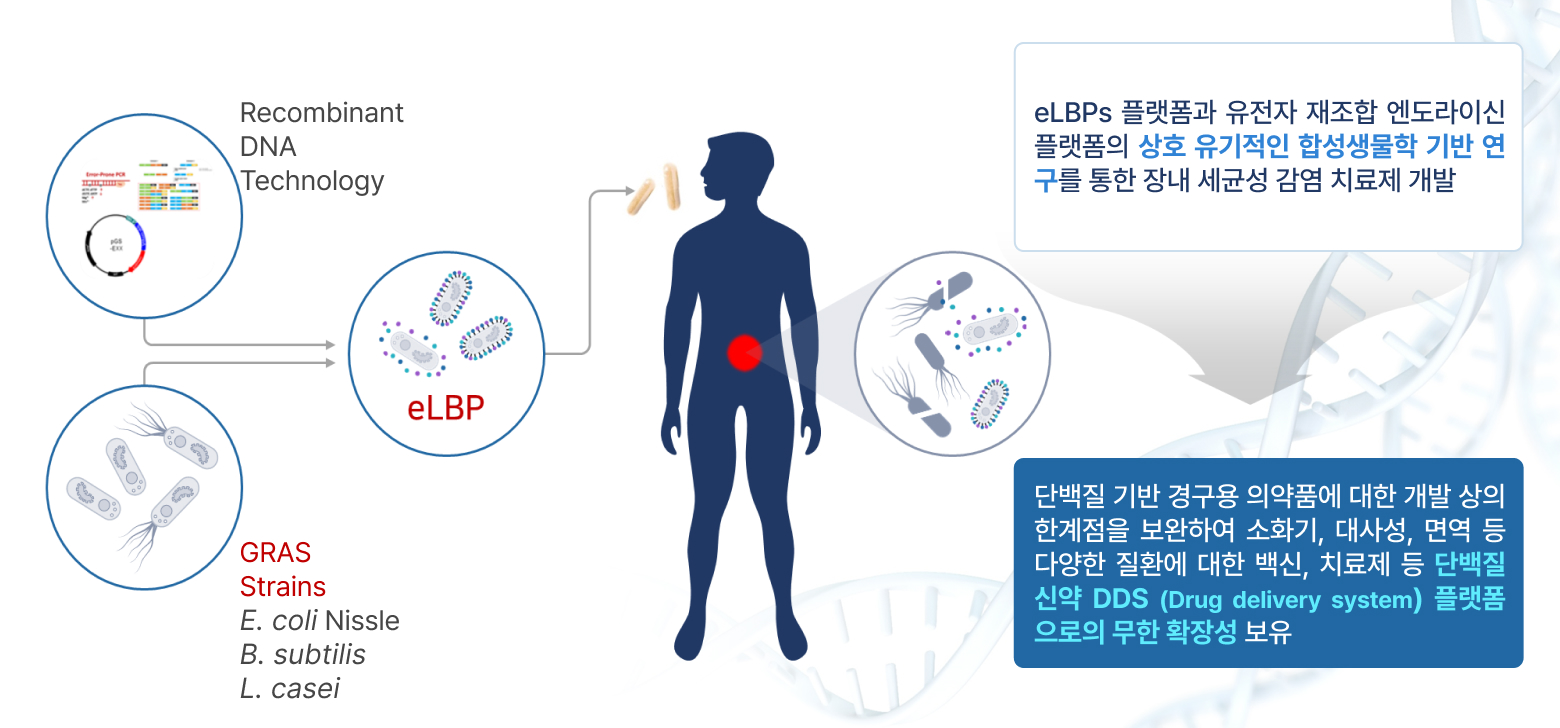
① eLBPs(Engineered Live Biotherapeutics Products) 기술
- 유전자 재조합 기반 생균 치료제
 유전자 조작 생균의약품(eLBPs)
유전자 조작 생균의약품(eLBPs)
‘살아있는 의약품’이라고 불리며, 의약품 분비 미생물 착상 시 반복적 투약 및 주사가 불필요하고, 합성생물학의 의학 혁신 사례에 속하는 기술임
(출처: ‘합성생물학의 미래’, 과학기술정보통신부, 2023년)
- 2022년 12월, 세계 최초로 마이크로바이옴 치료제 레비요타(스위스 페링제약, 분변 이식 기술 기반)가 미국 FDA 승인을 받은 이후 국내·외 마이크로바이옴 산업은 급성장하고 있으나 현재 CDI, 궤양성대장염 등의 마이크로바이옴 치료제는 프로바이오틱스 투여 및 대변 이식 등 숙주의 미생물을 조절하는 일부 기술이 적용되어 심각한 부작용 유발 가능성이 있음
(출처: ‘마이크로바이옴 R&D 및 산업화를 위한 전략’, 국가생명공학정책연구센터, 2022) -
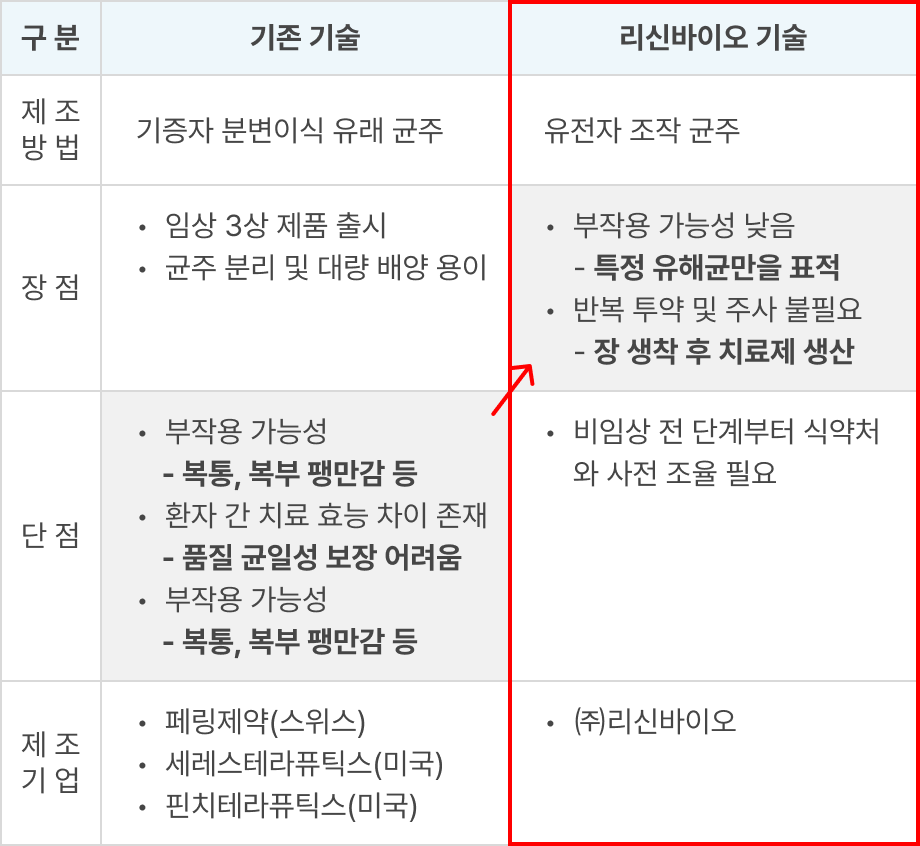
E. coli Nissle 1917, B. subtilis 등을 생균치료제로 형질 전환하여 단백질 신약 물질을 세포 표면에 디스플레이하거나 세포 외 분비하도록 제작하여 부작용 해결 및 치료 효과 개선
- 세포 표면 발현 시스템 개발 Know-how 확보
- 세포 외 분비 발현 시스템 개발 Know-how 확보
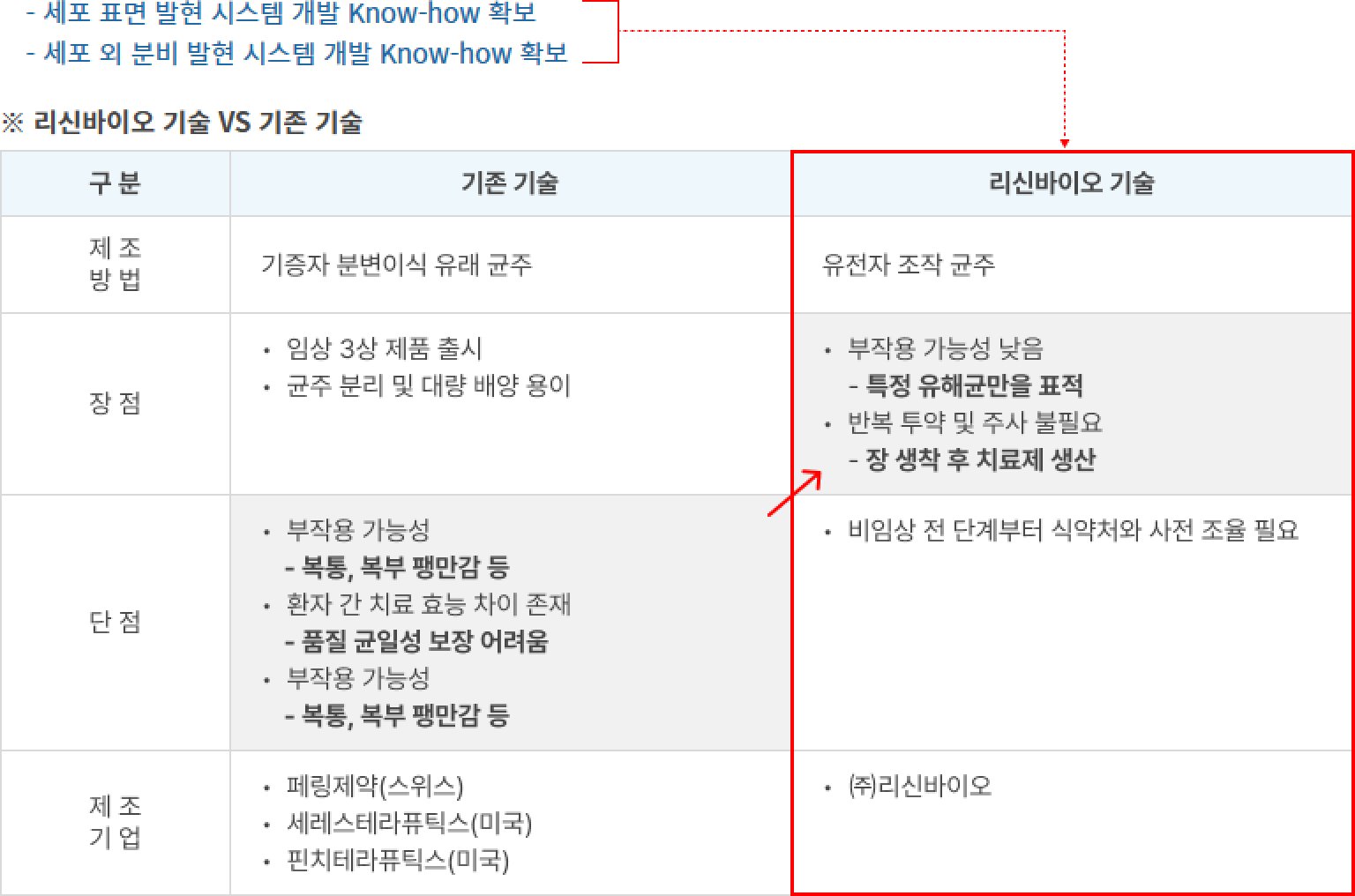
※ 리신바이오 기술 VS 기존 기술
② CMic-LB(엔도라이신) 기술
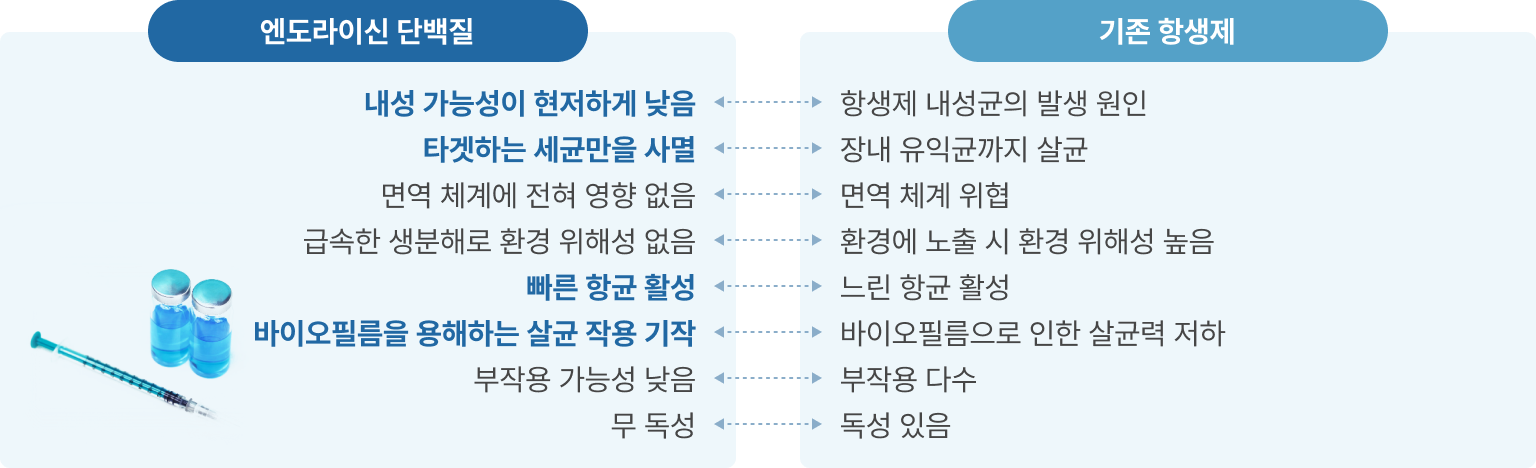
- 유전자 재조합 엔도라이신
- 기존 항생제의 많은 문제점을 해결할 수 있는 엔도라이신 단백질을 이용한 치료제를 개발 중이며
- 엔도라이신을 재조합 균주로부터 발현시켜 분리·정제하고 이를 주사제 혹은 신체에 도포하는 외형제 형태의 의약품 개발에 집중하고 있음
※ 엔도라이신 단백질 vs 기존 항생제
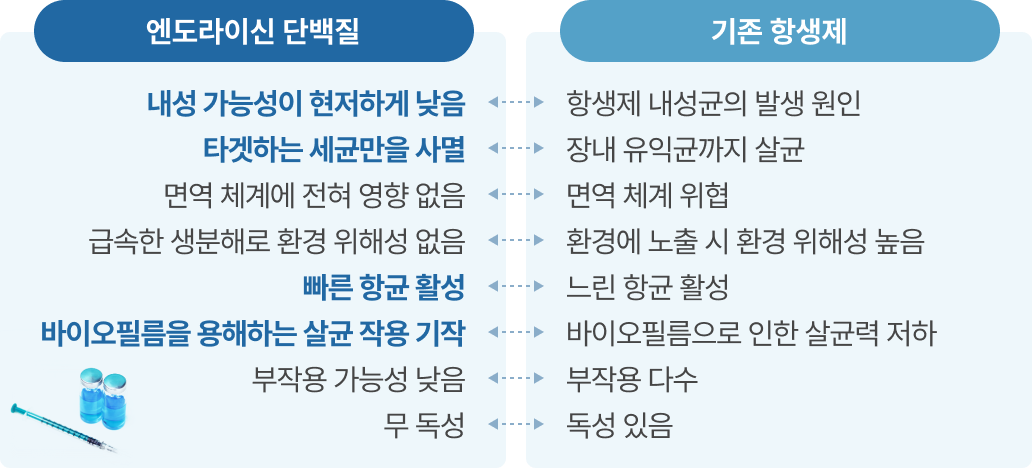
③ 항비만, 당뇨 치료제
- P. pastoris 효모 기반 eLBP플랫폼을 활용하여 GLP-1 유사체(Exenatide)와 GIP를 발현하는 균주를 경구 투여 가능하도록 개발 중임
- 이 접근법은 GRAS(Generally Recognized As Safe) 미생물을 이용해 장내에서 직접 치료 인자를 분비하도록 하여, 생체 이용률 저하 문제를 극복함
- 동시에 장내 마이크로바이옴과의 상호작용을 통해 대사 개선 효과를 유도할 수 있는 차세대 치료 방식으로 주목받고 있음
※ 기존 치료제의 한계
- 현재 시장의 주요 GLP-1 기반 치료제(예: Ozempic, Wegovy, Mounjaro 등)는 모두 주사제 형태로 제공됨
- 주사제는 복약 순응도(compliance)가 낮고, 주사에 대한 거부감이나 부작용으로 인해 장기 복용이 어려움
- 위장관계 부작용(구토, 메스꺼움, 복통) 및 고가의 비용 또한 치료 지속성을 저해함
개발 내용
개발 방향
엔도라이신의 한계를 극복하고 장(腸)내 병원성 세균 처치를 위한 합성생물학 기반의 경구용 eLBPs (Engineered Live Biotherapeutic Products) 생균치료제 및 주사제(IV) 개발
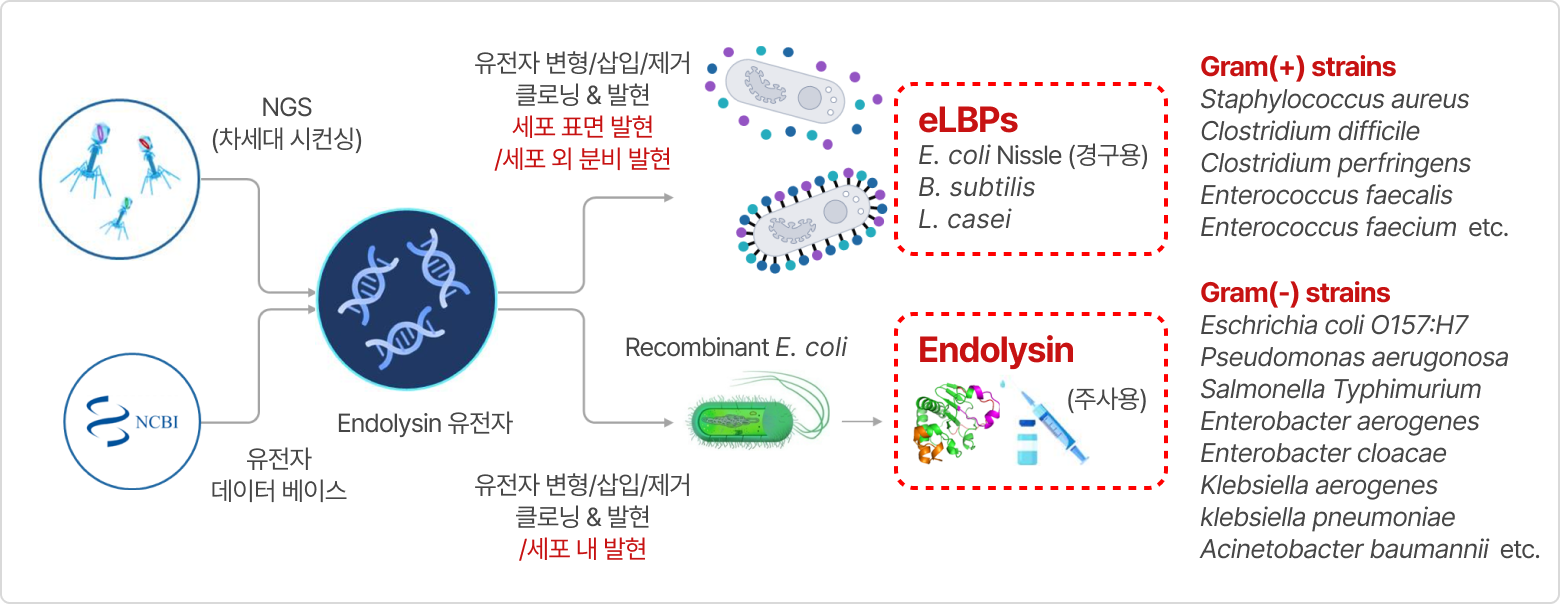
※ eLBPs(Engineered Live Biotherapeutic Products): 유전자를 의도적으로 삽입하거나 결실, 변형을 통해 조작된 미생물로 구성된 생물학적 치료제
핵심 기술
1. eLBPs 기술
① 작용기전(메커니즘)
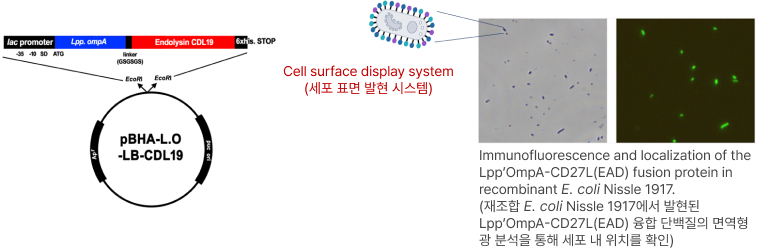
장내 세균성 감염 치료 경구용 단백질 신약으로 장내에서 유익한 활동을 하는 프로바이오틱스(probiotics) 균주인 E. coli Nissle 1917, B. subtilis 등에 목적 유전자를 도입하여 엔도라이신 등 단백질 신약 물질을 세포 표면에 디스플레이(display) 하거나 혹은 세포 외 분비(secretion) 할 수 있게 제작하는 기술
→ 반복적 투약 및 주사가 불필요한 차세대 마이크로바이옴 고도화 기술로서 환자의 비용 절감은 물론 기존 치료제의 부작용 또한 현저하게 낮출 수 있음
 엔도라이신의 불안정성을 해결하고 장내 세균성 감염을 치료하는 경구용 치료제 개발
엔도라이신의 불안정성을 해결하고 장내 세균성 감염을 치료하는 경구용 치료제 개발
- 인체 대상 경구용 eLBPs 개발
② 보유 기술
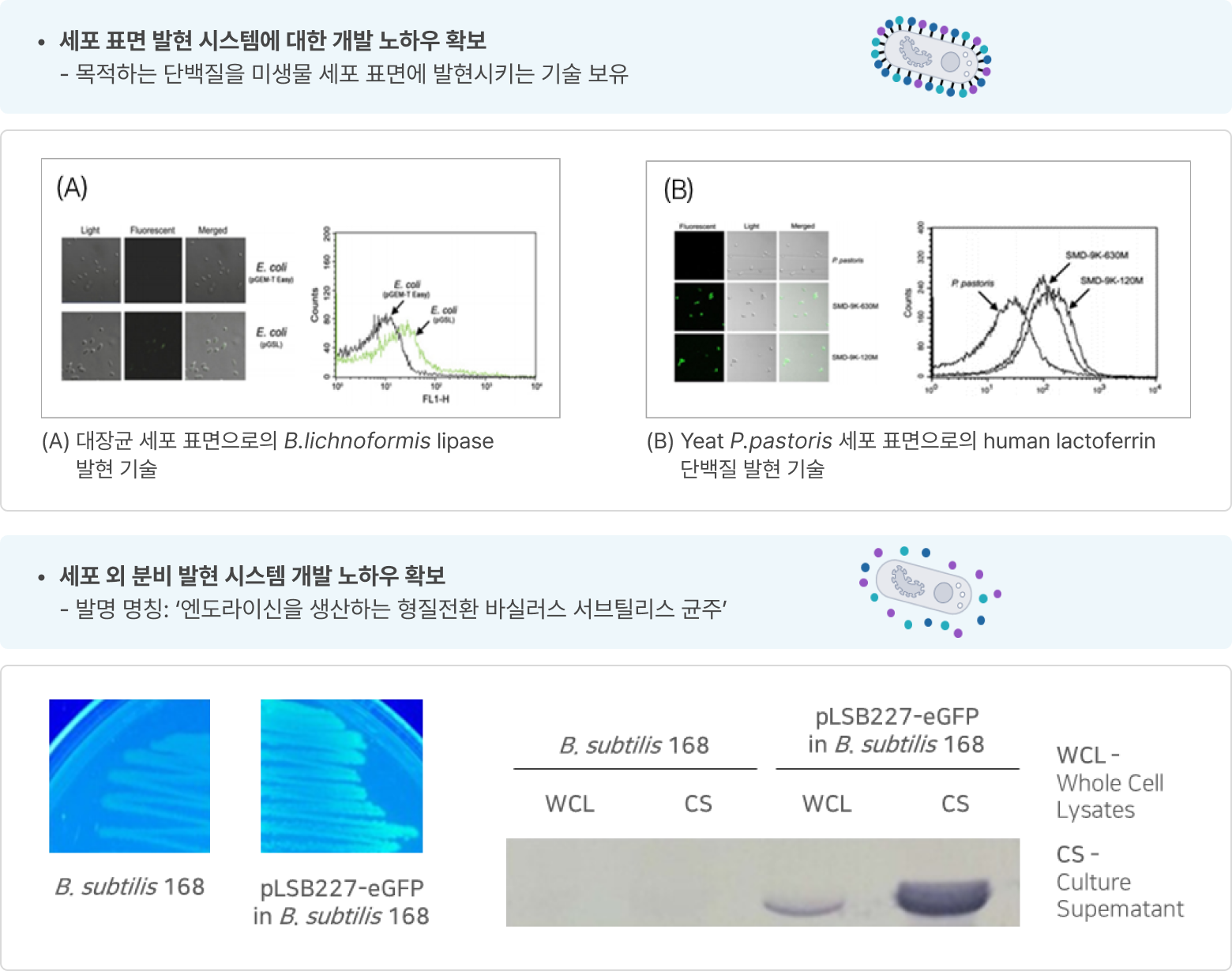
- 세포 표면 발현 시스템에 대한 개발 노하우 확보
- 목적하는 단백질을 미생물 세포 표면에 발현시키는 기술 보유
- 세포 외 분비 발현 시스템 개발 노하우 확보
- 발명 명칭: ‘엔도라이신을 생산하는 형질전환 바실러스 서브틸리스 균주’
③ eLBPs R&D 현황

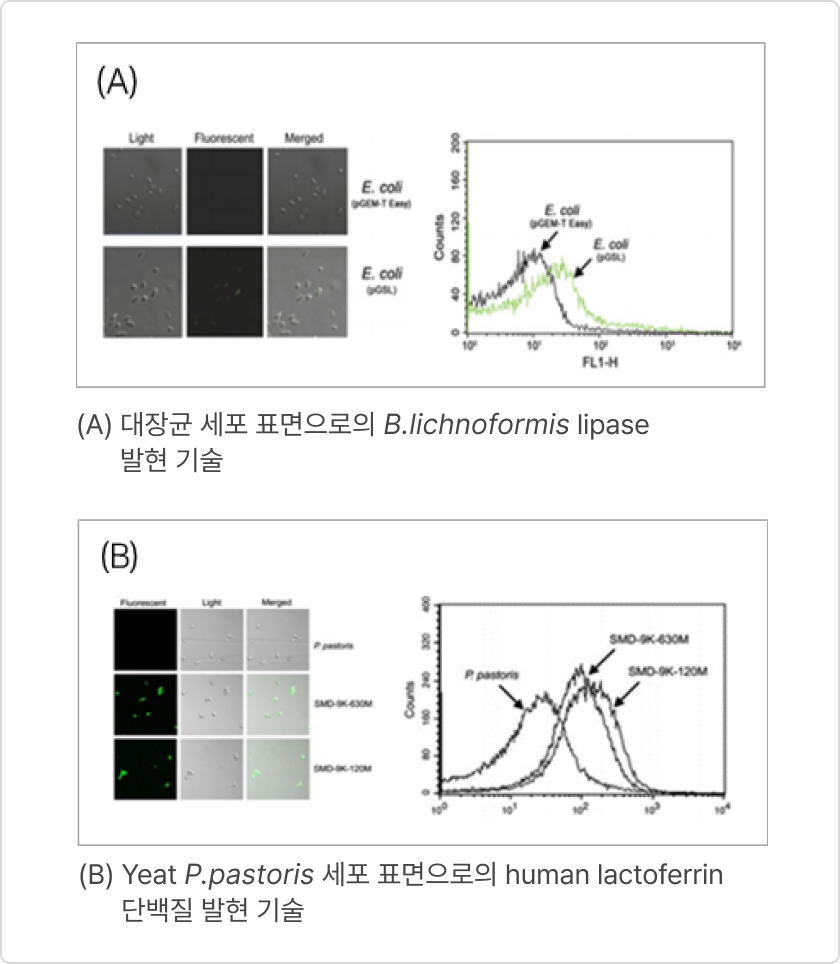
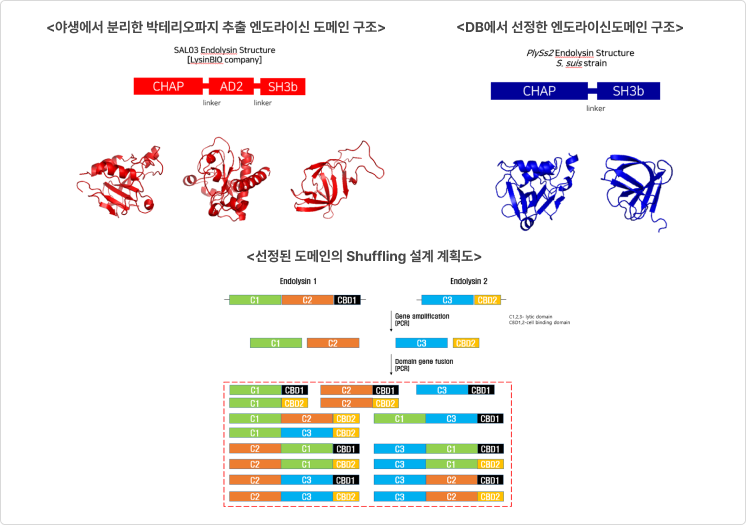
- GRAS strain E. coli Nissle 1917을 활용한 세포 표면 발현기술 확립
❶ 세포표면 발현 설계도

❷ 세포표면에 발현된 엔도라이신의 항균 활성(좌측: 샘플 주위에 clean zone 형성)

❸ 세포표면 발현 확인(엔도라이신에 형광물질 도포 - 우측 노란색)

❹ UV 이용세포 엔도라이신 표면 발현 확인


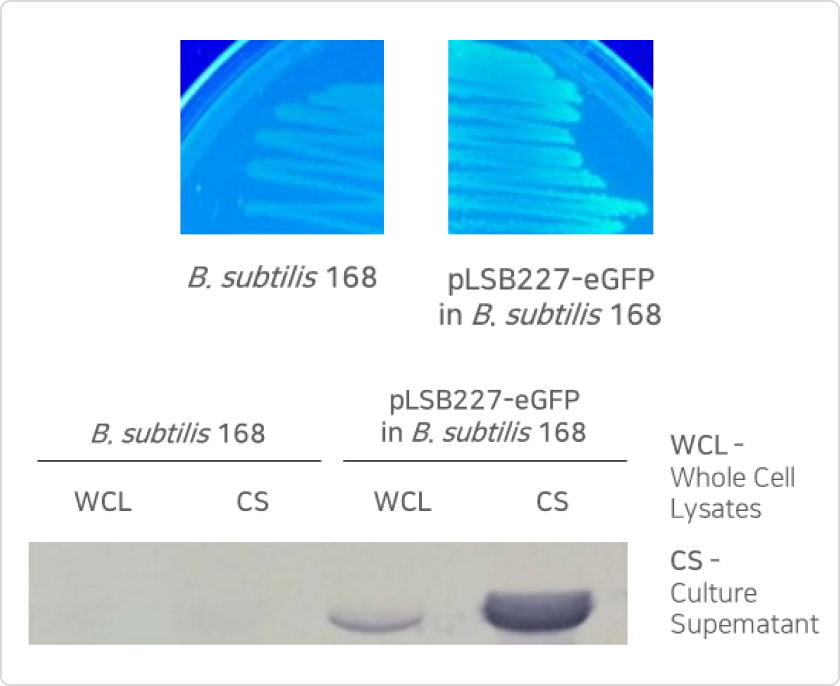
- GRAS strain B. subtilis를 활용한 세포 외 분비 발현기술 확립
* 현재 B. subtilis, E. coli Nissle1917 등에서 세포 외 분비 효율이 높은 signal peptide library 구축 완료


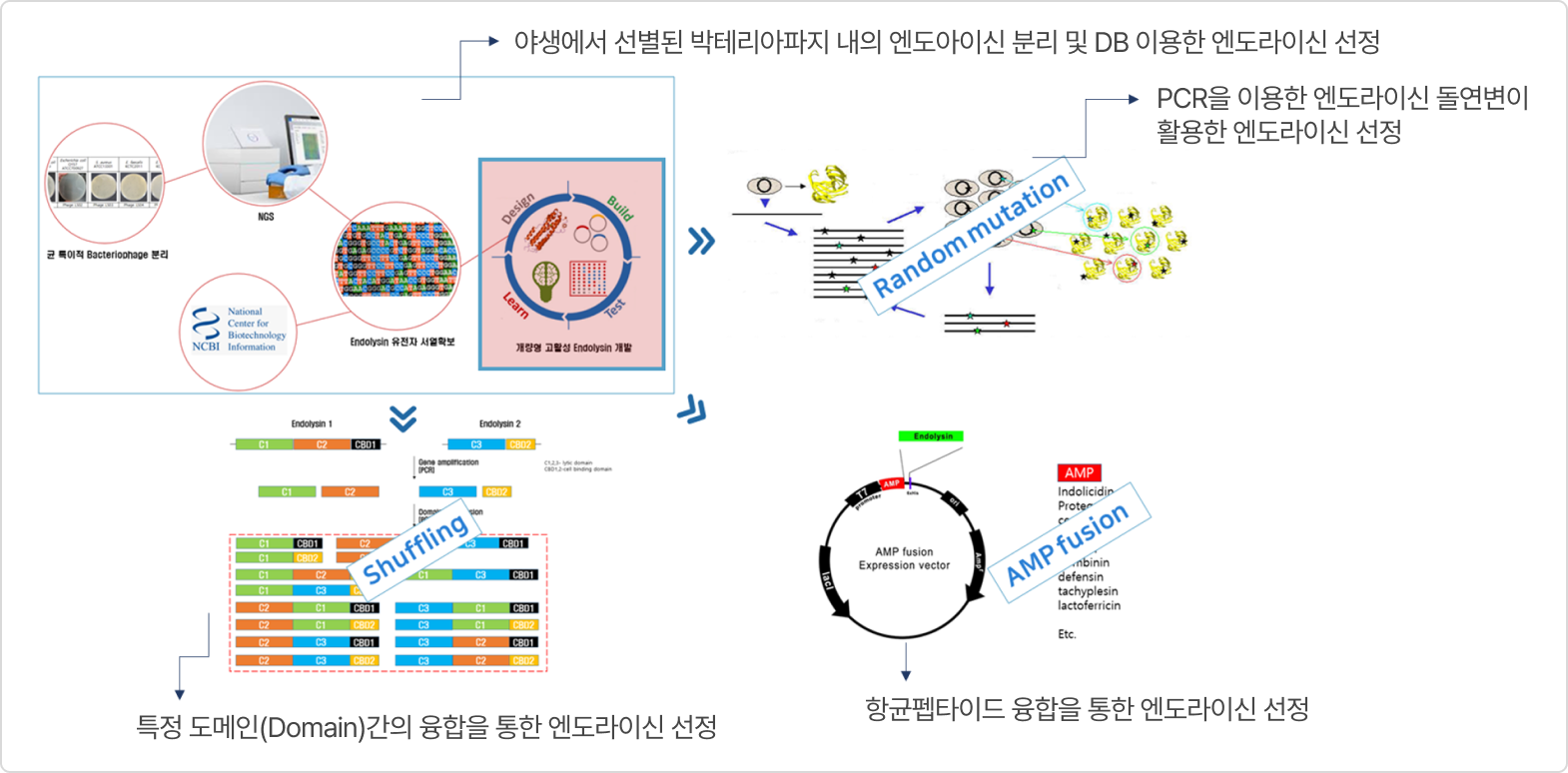
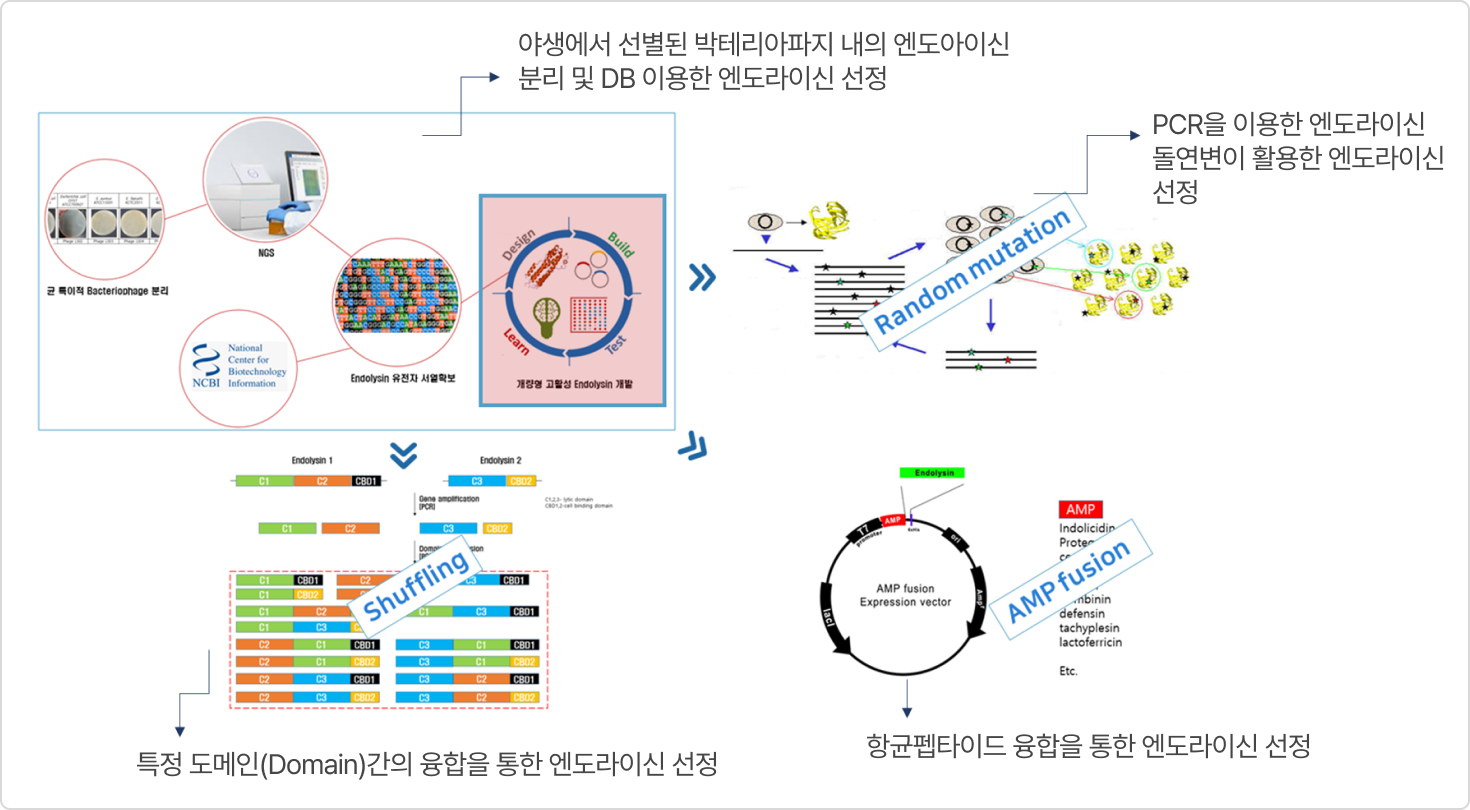
2. CMic-LB Technology (맞춤형 엔도라이신 선별 기술)
- 특정 도메인(Domain)간의 융합을 통한 고활성 엔도라이신 확보
- AMP(항균활성 펩타이드) 융합을 통한 그람 음성균 외막(OM) 효율적 투과
- 타겟 세균 선택적 공격
- 기존 항생제와는 다른 작용기작으로 내성균에 대한 효과적 사멸 효과
- 타겟세균 특이적 엔도라이신 유전자 교체만으로 새로운 파이프라인 확보 가능

개발 파이프라인
- eLBPs 기술: eLBPs기반 CDI Lead Compound 선발, 가금티푸스 항생제 대체제 생산
- CMic 기술: 유전자 재조합 엔도라이신 Lead Compound 최적화, PILOT 생산 SOP 확립
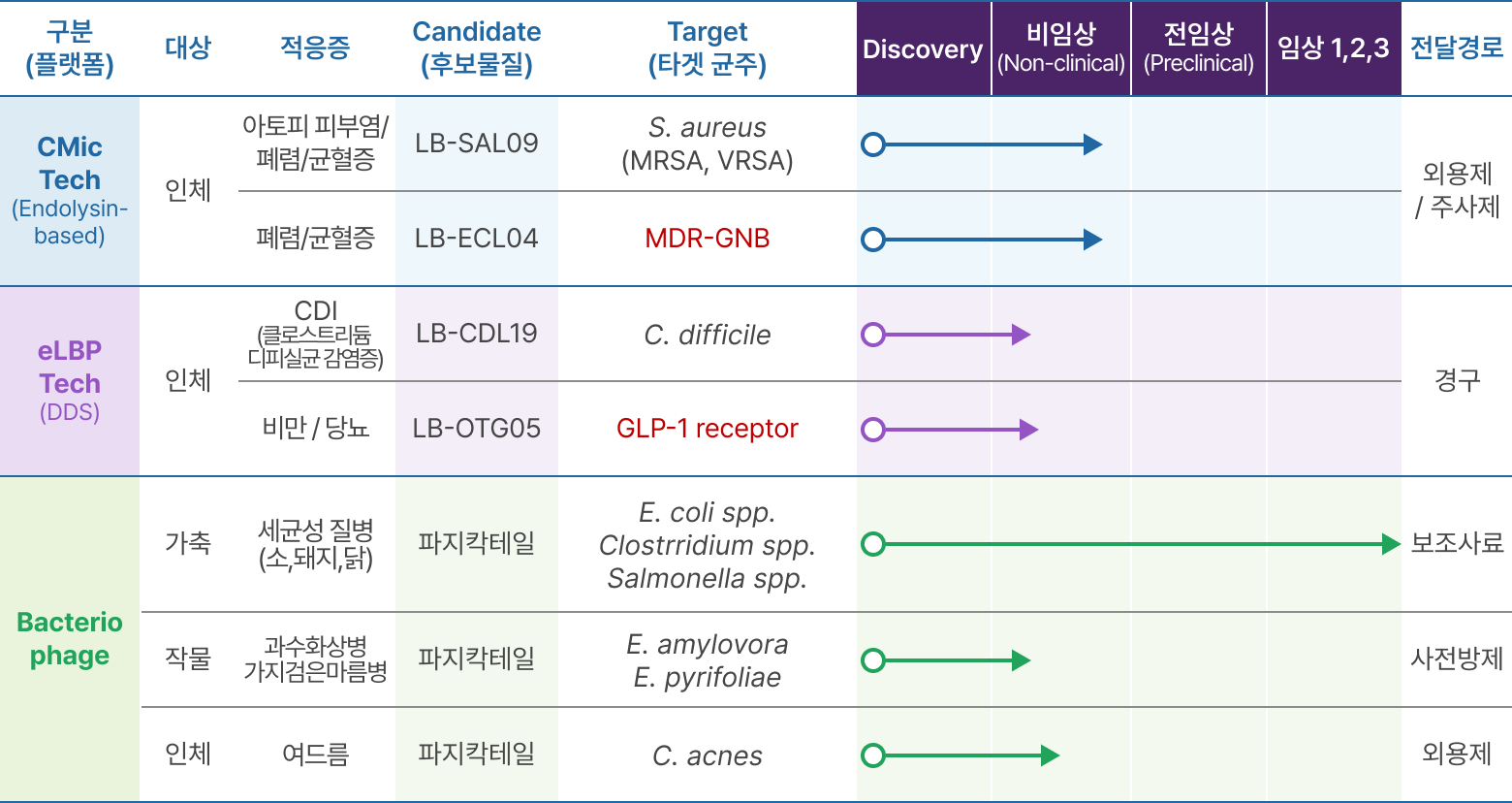
※ 용어 설명
- 적응증 : 어떠한 약제나 수술 등에 의해 치료 효과가 기대되는 병이나 증상
- CMC(Chemical, Manufacturing and Control) : 의약품을 만드는 공정 개발과 품질 관리 확립 단계
- Lead Compound : 선도물질
- 생산 SOP : 생산 표준운영절차
- CDI : Clostridium difficile 감염증(장내 질병 관여균)
- E. coli spp. : 대장균 - 수인성·식품매개 설사 원인균
- Clostridium spp. : 그람양성, 무산소성 포자형성(내생포자) 병원성 세균
- Salmonella spp. : 살모넬라균(식중독균)
- E. amylovora : 화상병의 원인균
- E. pyrifoliae : 아시아 배(Pyrus pyrifolia)에서 발생하는 세균성 가지검은마름병의 병원균
- C. acnes : 여드름의 대표적 원인균으로 알려진 Cutibacterium acnes의 약칭
- C. difficile : 클로스트리디움 디피실균(항생제로 인한 장염)
- GLP-1 receptor : 글루카곤유사 펩타이드-1 수용체
- S. aureus (MRSA, VRSA) : 포도상구균(메치실린계, 반코마이신저항성)
- MDR-GNB (Multidrug-resistant Gram-negative bacteria) : 다제 내성 그람음성균
개발 제품군
1. 박테리오파지
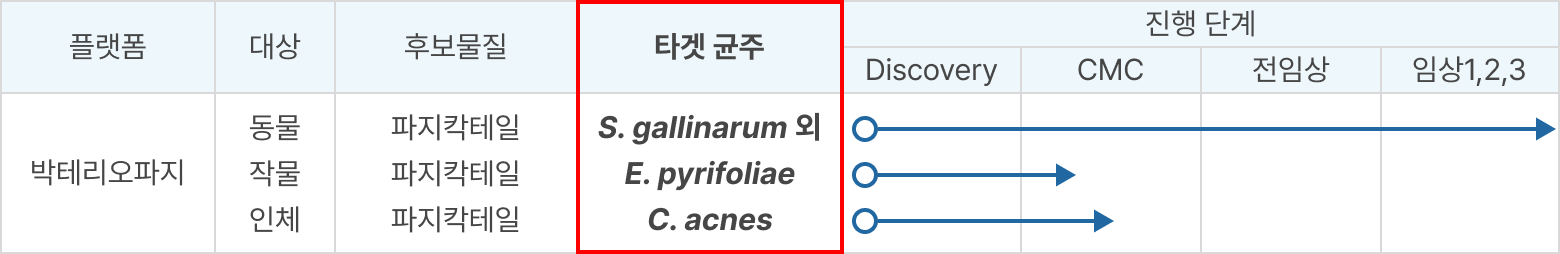
① 개발 현황
- 가금류 병원성 원인균 살모넬라 타겟
- 2025년 육계, 오리, 산란, 중계용 보조사료용 원료를 사업화
→ 이후 양돈, 축우용 제품으로 확대 목표

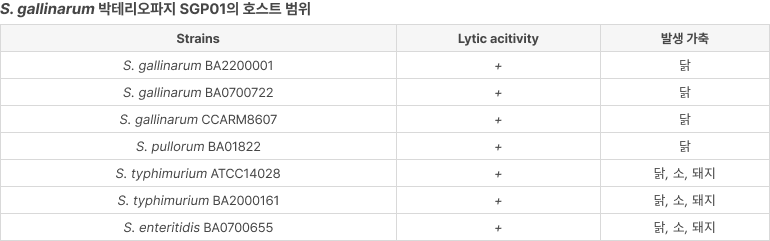
- S. gallinarum : 조류티푸스(가금티푸스)
- S. typhimurium : 살모넬라증(식중독)
- S. enteritidis : 살모넬라 장염균(Salmonella enteritidis)
- S. pullorum : Salmonella 속의 한 혈청형(Salmonella pullorum)으로, 닭 등 가금류에서 ‘추백리(살모넬라증)’를 유발하는 병원성 세균
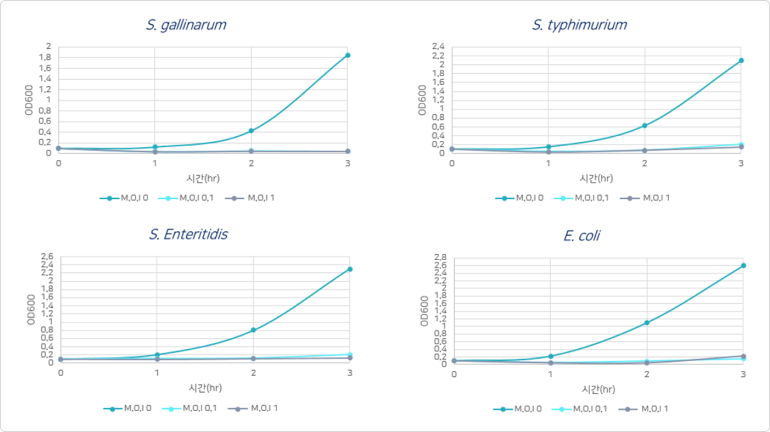
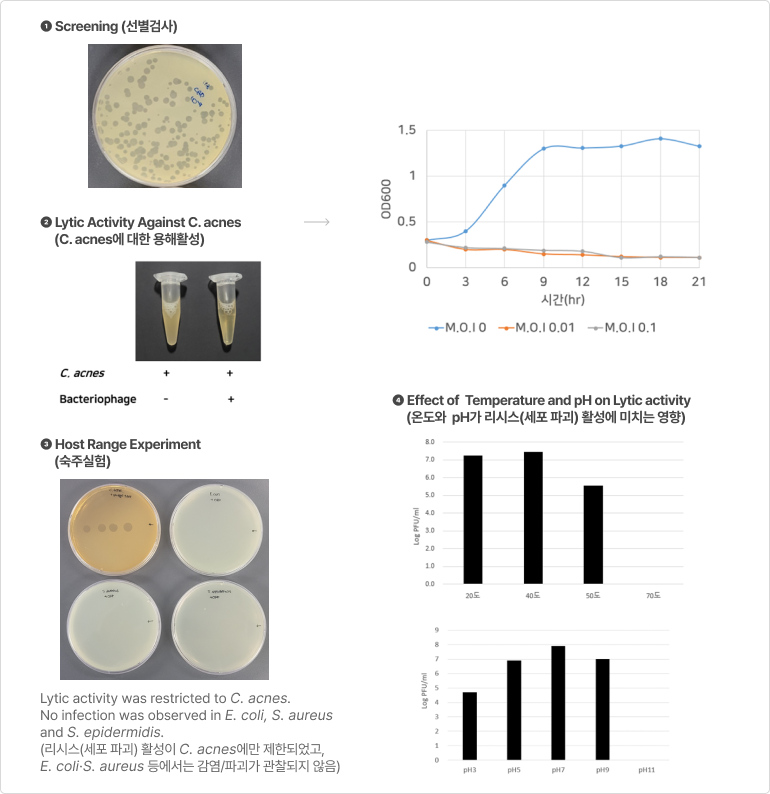
PhagePlus+의 항균활성 - Target 특이적 사멸 효과 확인
❶ 항균활성
- PhagePlus+는 유익균의 성장에 영향이 없음

- PhagePlus+를 첨가할 경우 targe하는 병원균은 배양 3시간이 지나도 전혀 성장하지 못함
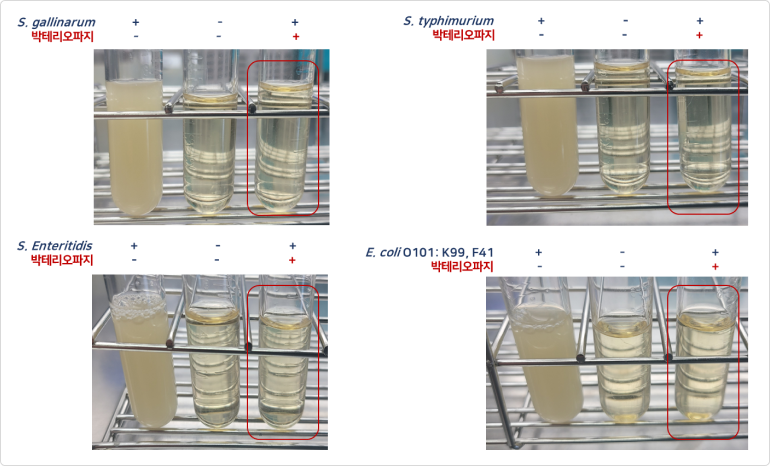
- 낮은 M.O.I 농도에서 병원성 세균이 성장하지 못함
- 이는 매우 강력한 감염효과(항균력)을 갖고 있음을 의미
* M.O.I(Multiplicity of Infection): 단위 세포당 감염된 바이러스 수
M.O.I = 0 → 파지 미처리
M.O.I = 0.1 → 세균 10개:파지 1개
M.O.I = 1.0 → 세균 10개:파지 10개
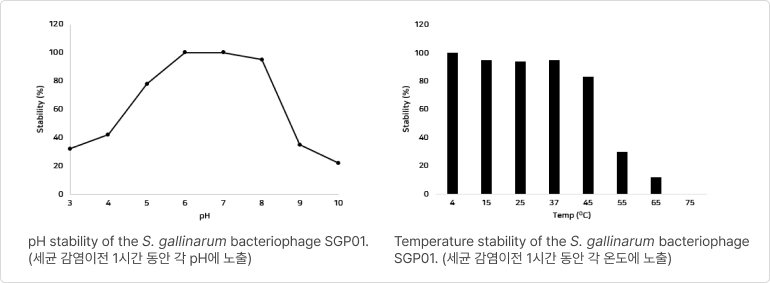
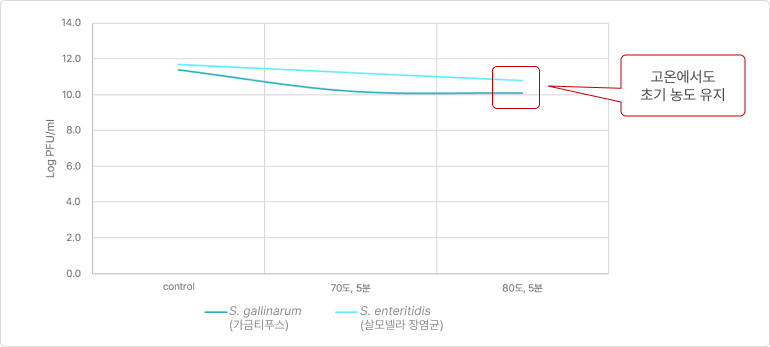
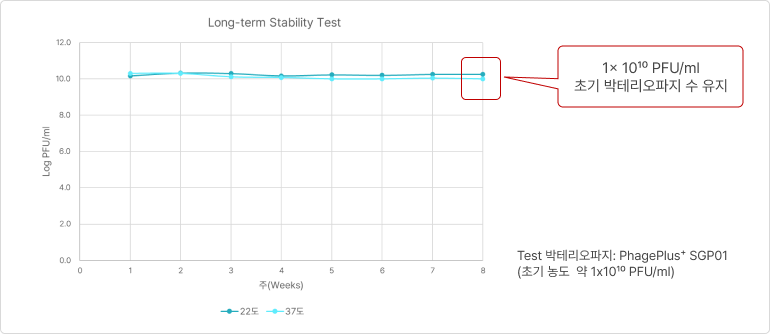
❷ 열 안정성 (Thermal stability)
- 배합사료 제조 시 열처리 공정을 거치더라도 PhagePlus+ 안정성 유지
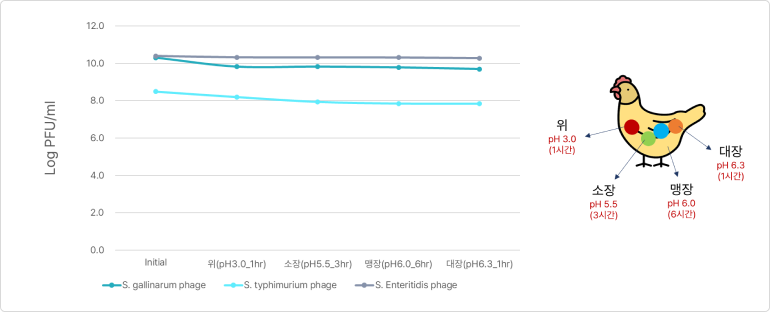
❸ 장내 안정성 (Interstinalstability)
- 소화과정 모의모델에서 위-소장-맹장-대장의 모든 부위에서 매우 안정적으로 PhagePlus+ 농도가 유지되는 것을 확인함
❹ 장기 보관 안정성
- 상온 및 고온의 보관 조건에서도 초기 PhagePlus+ 농도를 유지함에 따라 안정성(stability)이 높음을 의미
S. gallinarum 처치를 위한 eLBPsystem 개발
• 하이라인 브라운 치킨 모델에 S. gallinarum를 감염시킨 실험군

❶ 생존율
- Endolysin secretion system을 섭취한 실험군(Drug B)에서 기존 항생제 처리 실험군과 유사한 생존율 확인

❷ 닭 체중 증체량 평가
- Amount of weight gain of DPI 7 compared to DPI 0
(* DPI: Day Post Infection)

❸ 혈액 내 S. gallinarum 정량 평가

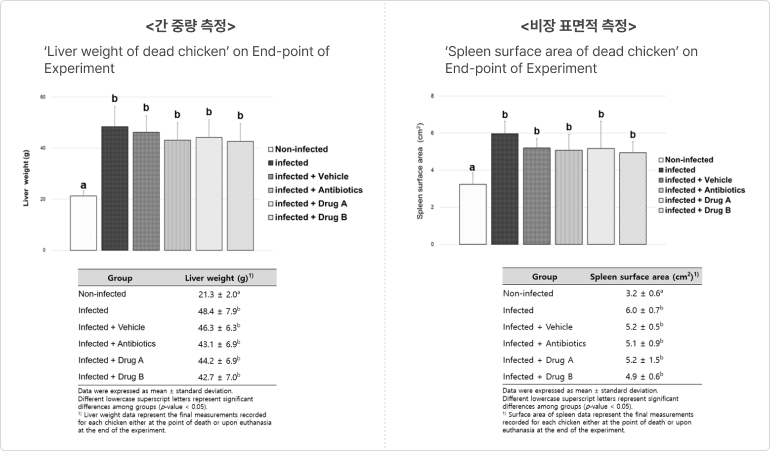
❹ 주요 장기 변화 여부 - 간 중량 측정
- 가축내세균 감염시간과 비장의 크기는 비대해 지는 경향이 있음
→ 면역 체계가 감염을 조절하려는 노력의 결과임 - Endolysin secretion system을 섭취한 실험군(Drug B)에서 간과 비장의 크기가 약간 덜 비대해지는 결과 확인
(작물) 박테리오파지 기반의 바이오농약 개발 진행 중
- 화학 농약의 한계를 극복하고 병을 선제적으로 예방할 수 있는 박테리오파지 기반의 바이오농약 개발 진행 중
- 박테리오파지를 이용한 작물 방제 연구

* 가지검은마름병
- 사과와 배에 치명적인 세균성 질병으로, 감염 시 잎, 꽃, 과실이 불에 탄 듯 검게 말라 죽으며 빠르게 번져 2~3년 안에 과수원 전체를 폐원시켜 막대한 경제적 손실을 야기
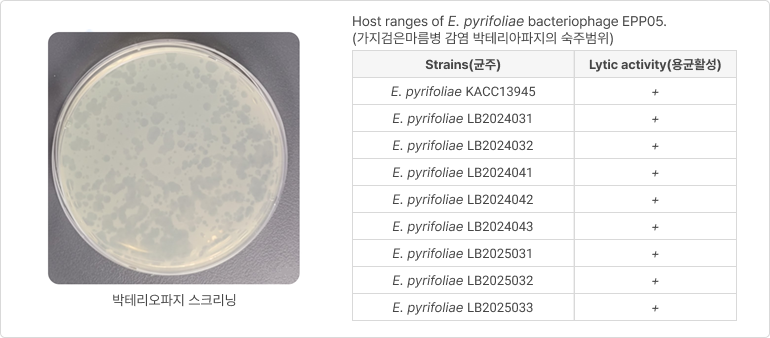
- 현재 살균제로서 동제 화합물(약제 살포), 항생제 사용
- 가지검은마름병 감염 박테리오파지 숙주범위
- 과수 가지검은 마름병 억제 효과

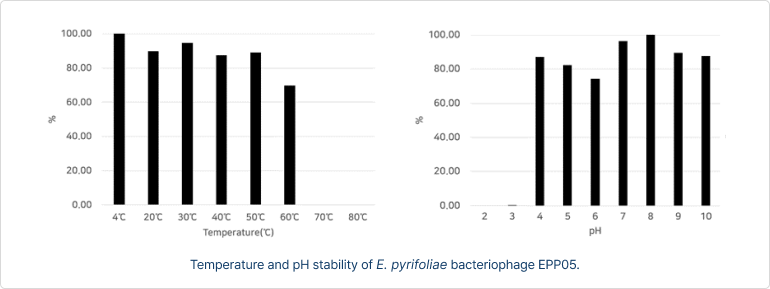
- 가지검은마름병 감염 박테리오파지의 온도와 산도(Ph) 안정성(저항성)
(여드름) 여드름 원인균 관련 박테리오파지 연구
- 여드름 치료를 위한 안전하고 효과적인 항생제 대제제로서 박테리오파지 기반의 제품 개발
- 여드름 원인균 관련 박테리오파지 연구사례
(* 여드름 발생 원인균 - Cutibacteriumacnes)
② 개발 현황 및 성과
- 생산공정 설계
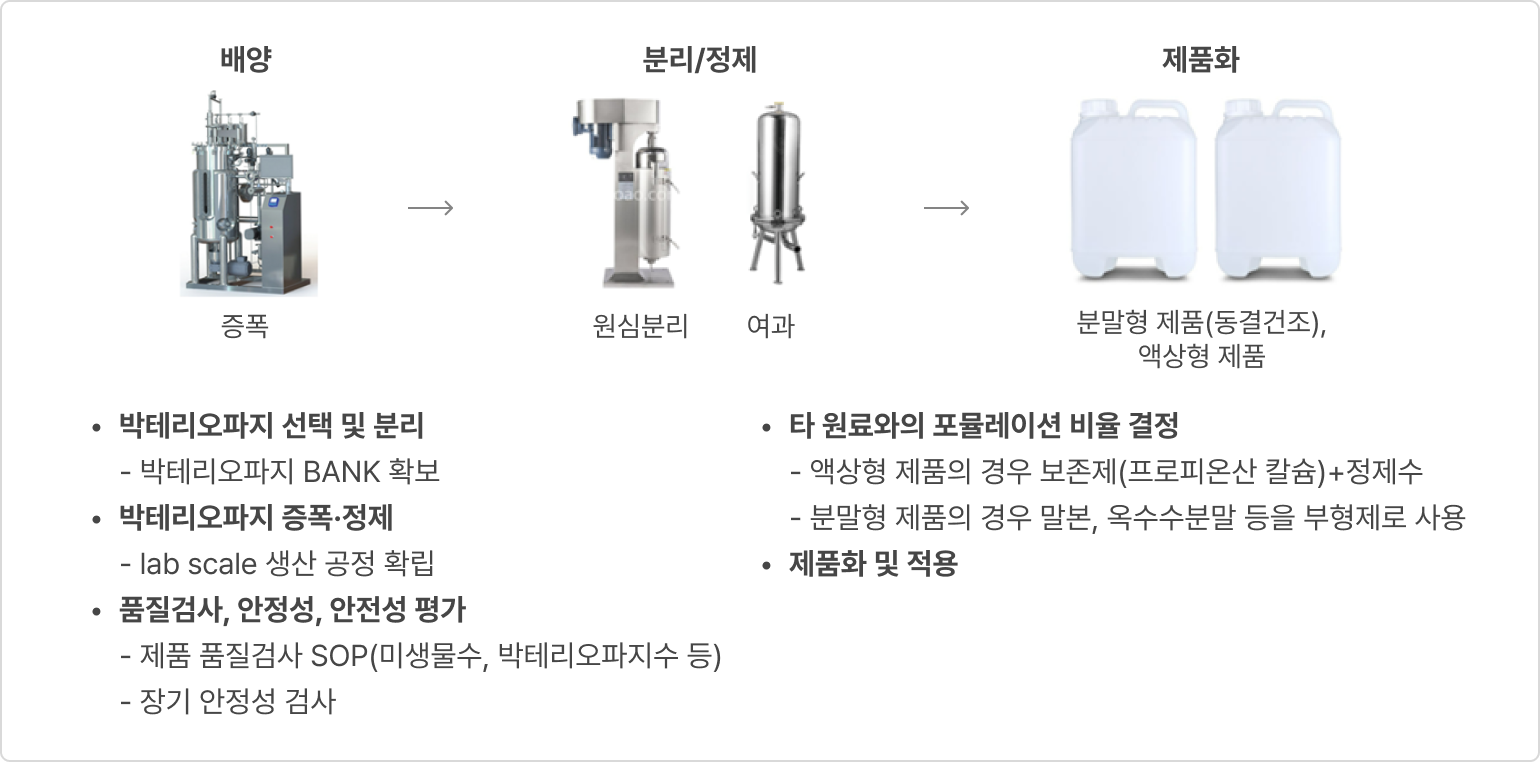

- 박테리오파지 생산품질관리

- 생산스케줄
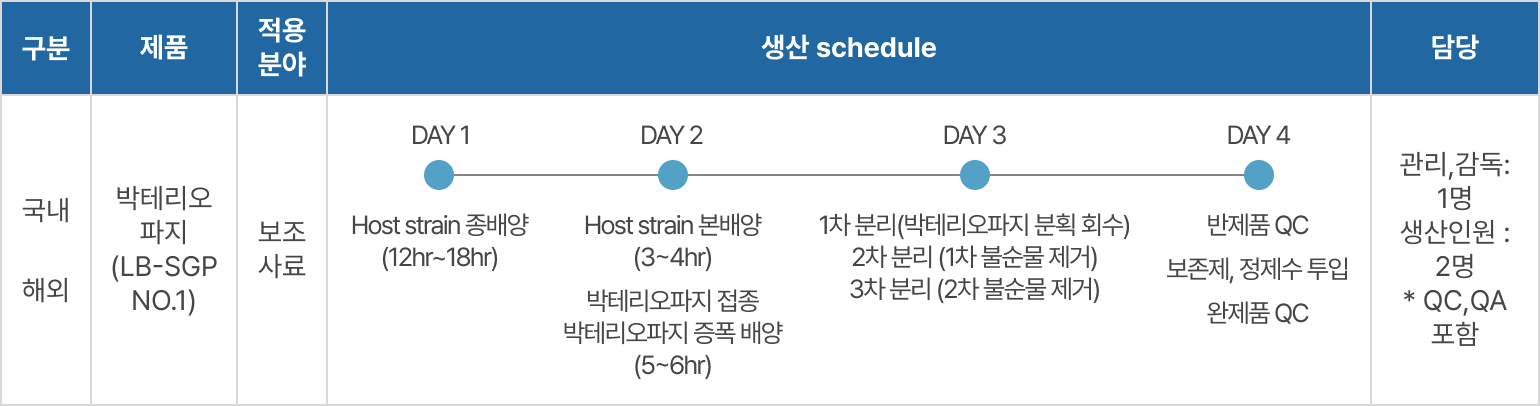
- 단순 배치(batch) 방식 적용 시 월간 예상 생산 능력 (1 batch: 10L 기준)


- 연구개발 성과를 바탕으로 국내 및 해외 상장 제약회사와 전략적 제휴
- 안정적인 매출 창출을 통한 캐시카우 확보
<국내>
- 대한뉴팜㈜과 전략적 제휴 협약(투자, 공동연구) 체결
- 1차로 리신바이오의 연구 성과 중 가금티푸스(조류) 예방용 항생제 대체제 생산(공장 확보)
- 추후 돼지, 소로 품목 확대 예정 - 대한뉴팜㈜을 통한 국내 판매 예정(예상 매출 2026년 5억원)
<해외>
- 싱가포르 제약사 자이로닉스와 전략적 제휴 체결로 해외 진출의 교두보를 확보
- 리신바이오의 eLBP 기반의 축산용 항생제 대체재의 공동연구, 마케팅, 핵심 분야 지원
* 싱가포르 Xylonix 측에서 가금티푸스(S. gallinarum) 제품 생산 관련하여 멕시코 Bachoco사 및 브라질 BRF사에 제안
<참고> 대한뉴팜과의 제품공급계약서

2. 폐혈증, 균혈증, 폐렴, 피부감염

① 개발의 필요성
- 항생제 개발이 항생제 내성균 문제로 한계에 봉착
- MRSA, VRE, PDR…슈퍼박테리아

-
2050년 AMR 위험 전망
- 전세계 사망자 1,000만 명
- 경제손실 규모 11경($100 trillion)

※ 변종으로 인한 기존 항생제에 대한 내성 발생(예: MRSA, VRSA)
| MRSA (Methicillin Resistant S. aureus) |
|
| VRSA (Vancomycin Resistant S. aureus) |
|
* MRSA, VRSA은 법정감염병으로 의료관련 감염병 ‘다제내성균 6종’ 내 포함
② MRSA, VRSA 감염 치료제 개발 현황
- 메치실린계 및 반코마이신 저항성 황색포도상구균을 타겟으로 하는 재조합 엔도라이신 연구 설계
- 선정된 신규엔도라이신 SAL-09의 농도별 항균활성도 연구 결과
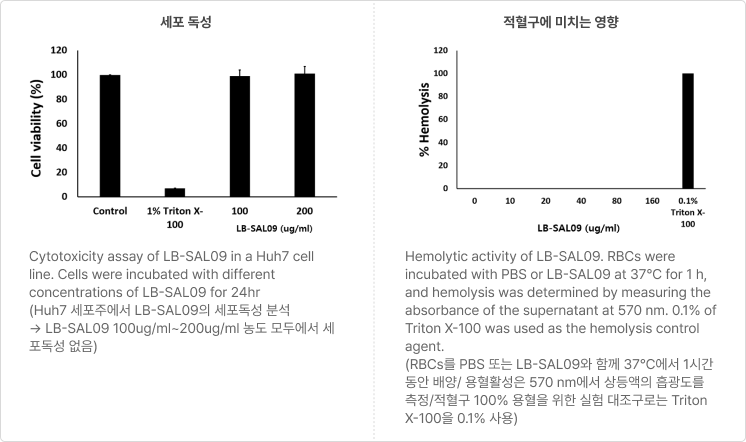
- 주사제로 개발하기 위한 세포 독성(좌측)과 적혈구에 미치는 영향(우측) 실험 결과
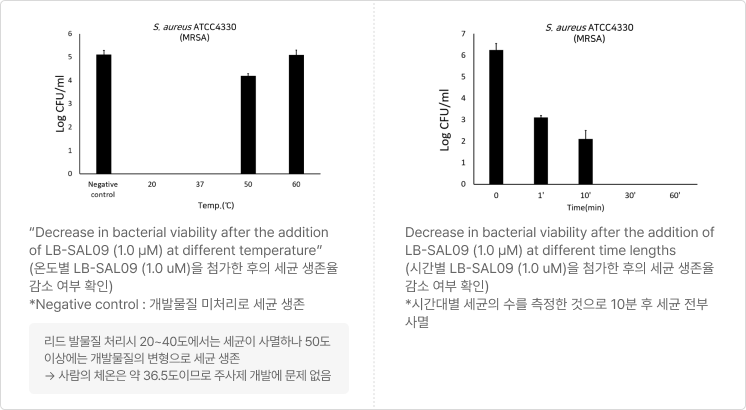
- 세포 독성 및 용혈현상이 나타나지 않는 결과 - 온도별·시간대별 세균 생존율 실험 결과
- 환자로부터 분리한 항생제 내성 임상분리주에 대한 항균활성 실험 결과
- 표준균주와 내성균주에 모두 효과 있음 (좌측)
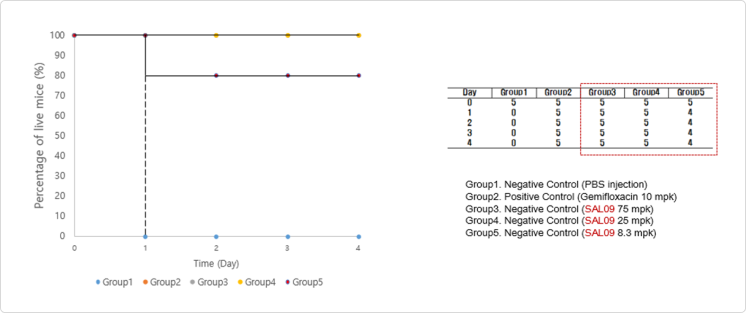
- 내성균주에 대한 효과 용량 실험 결과 (우측) - S. aureus 전신감염 mouse model을 이용한 LB-SAL09의 유효성 확인
| |
|
황색포도상구균에 대한 LB-SAL09
* 고농도일수록 빠른 항균 활성 보임 |
빠른 항균 속도를 보여주는 동영상
왼쪽: liquid media |

 현재 아토피 피부염 치료제로서의 가능성 확인을 위해 충북대 수의대와 함께 추가 동물 실험 진행 중
현재 아토피 피부염 치료제로서의 가능성 확인을 위해 충북대 수의대와 함께 추가 동물 실험 진행 중
실험 2 (*실험군 편성)
〔실험군〕Experimental groups of methicillin-resistant Staphylococcus aureus
(MRSA)infected C57BL/6 mouse model
(메티실린 내성 황색포도상구균(MRSA) 감염 실험군 C57BL/6 마우스 모델)

1 The bacterial cell suspension of methicillin-resistant Staphylococcus aureus (MRSA) NCCP 14754 was administered on the skin wound (5 x 106 CFU/10 μL/wound, once; Day 0). After the administration of MRSA, Tegaderm film (3M Co., USA) was covered over the wound area and sealed.
메티실린 내성 황색포도상구균(MRSA) NCCP 14754의 세균 세포 현탁액을 피부 상처 부위에 투여(5 x 106 CFU/10 μL/상처, 1회, 0일차), MRSA 투여 후 테가덤 필름(미국 3M사)을 상처 부위에 덮고 밀봉
2 Treatment was administered on each wound from experimental day 0 to day 6, daily once.
실험 0일째부터 6일째까지 각 상처에 매일 한 번씩 치료를 시행
3 The novel microbial drug was given by LysinBio corp. (Korea). Each treatment of 50 μL was administered on the skin.
새로운 미생물 약물은 라이신바이오(한국)에서 제공, 50μL의 각 처리가 시행
〔평가항목〕
- 체중 변화량 (피부감염)
- 창상 크기 변화량 (피부 감염)
- 창상 부위 MRSA, 정량평가 (피부 감염)
❶ 체중 변화량 (실험일 동안의 마우스의 무게)
- 실험군(Infected+Drug)에서 정상에 가까운 체중으로 복원

* Asterisk indicate groups that show significant differences compared to the ‘Infected’ group.
(별표는 ‘감염된’ 그룹과 비교하여 유의미한 차이를 보이는 그룹을 나타냄)

• Data were expressed as mean ± standard deviation.
(데이터는 평균 ± 표준 편차로 표현)
• Different lowercase superscript letters represent significant differences among groups within the same experimental day. (p-value < 0.05).
(서로 다른 소문자 대문자는 동일한 실험일 내에 그룹 간에 유의미한 차이를 나타냄(p-값 < 0.05))
❷ 창상 크기 변화량(실험일 동안의 상처 크기 변화)
- 실험군(Infected+Drug)에서 상처 크기 감소

* Asterisk indicate groups that show significant differences compared to the ‘Infected’ group.
(별표는 ‘감염된’ 그룹과 비교하여 유의미한 차이를 보이는 그룹을 나타냄)

• Data were expressed as mean ± standard deviation.
(데이터는 평균 ± 표준 편차로 표현)
• Different lowercase superscript letters represent significant differences among groups within the same experimental day. (p-value < 0.05).
(서로 다른 소문자 대문자는 동일한 실험일 내에 그룹 간에 유의미한 차이를 나타냄(p-값 < 0.05))
• The values from day 1 to day 6 represent the magnitude of the change for data of day 0, thus the data on day 0 was presented as N/A (Not Available)
(1일차부터 6일차까지의 값은 0일차 데이터의 변화 크기를 나타내므로 0일차 데이터는 N/A(사용할 수 없음)로 표시됨)
❸ 창상 부위 MRSA 정량평가(실험 종료 시점(6일째)에 ‘MRSA CFU/skin g’ 기록)
- 실험군(Infected+Drug)에서 MRSA 소멸

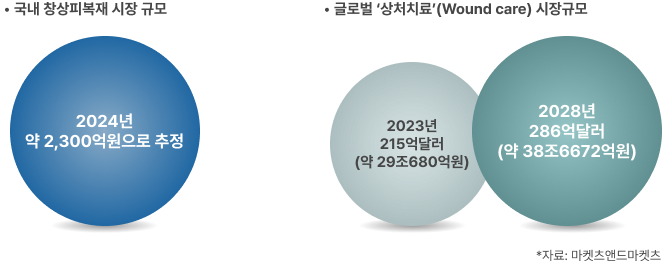
③ 창상피복재 시장규모 및 향후 계획
〔시장 규모〕
〔향후 계획〕
- 국내 : 제휴사인 대한뉴팜㈜과 협력하여 허가 진행 후 병의원 공급
- 해외 : 제휴사인 싱가포르 제약사 자이로닉스와 협력을 통한 해외 진출 모색
3. 폐혈증, 균혈증, 폐렴 등

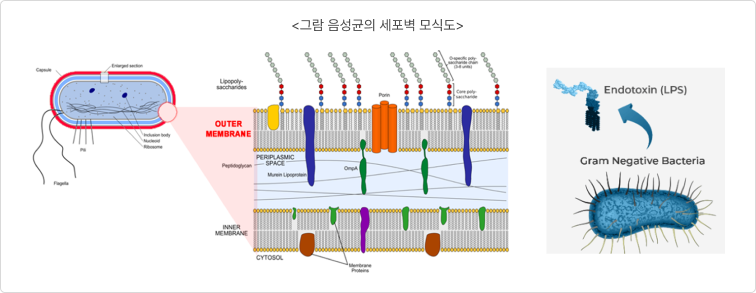
① 그람 음성균의 위험성(개발의 필요성)
- 그람 양성균과 달리 내독소(Endotoxin)로 작용하는 세포 외막(outer membrane) 존재
- 기존 항생제에 대한 내성이 나타남에 따라 기존 항생제 개발 방법은 한계가 있으며 새로운 전략 필요



② 개발 현황
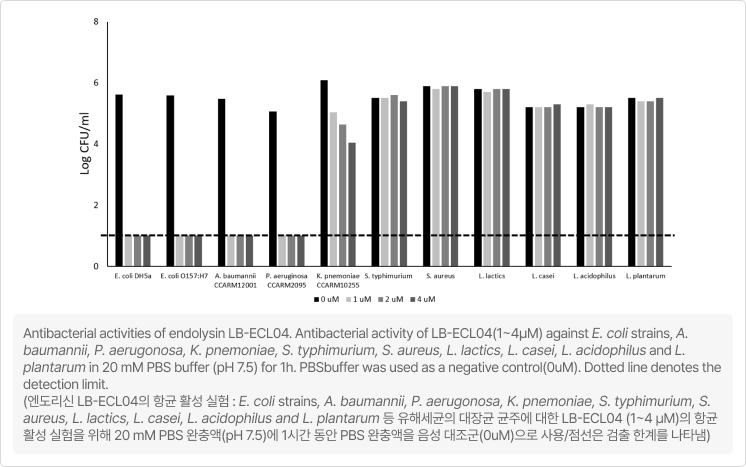
(Target strain: MDR-GNB) E. coli Bacteriophage 유래 endolysin 유전자 서열을 기반으로 한 신규 재조합 endoysin 개발 진행
- 리신바이오만의 신규 endolysin 선별
- 리신바이오 개발 물질의 유해균과 유익균 적용 결과
- 리신바이오의 개발 물질은 3종의 유해균에 효과를 보임 / 장내 다른 세균(유익균 포함)에는 영향을 미지치 않음

* 그람양성균과 그람음성균의 세포벽 차이




- 목적하는 유해세균(E. coli strains, A. baumannii, P. aerugonosa)에만 항균 활성이 있고, 유익균 및 다른 세균에는 영향을 미치지 않는 결과 데이터 확인
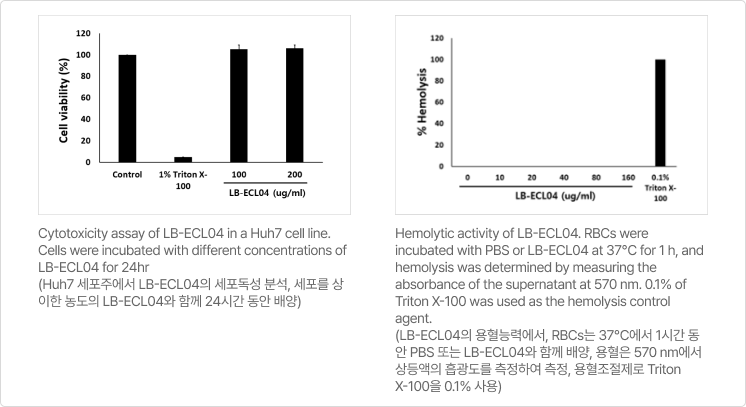
- 주사제로 개발하기 위한 세포 독성(좌측)과 적혈구에 미치는 영향(우측) 실험
- 모두 무해한 것으로 나타남 - 내성균에 대한 농도별 항균 활성도 체크
- 좌측 : 고농도에서 높은 활성도 보임
- 우측: 시간대별 세균수 체크 (1분 후 세균 전부 사멸) - 내성균주(E. coli, A. baumanni)에 대한 효과 용량 실험 결과 데이터
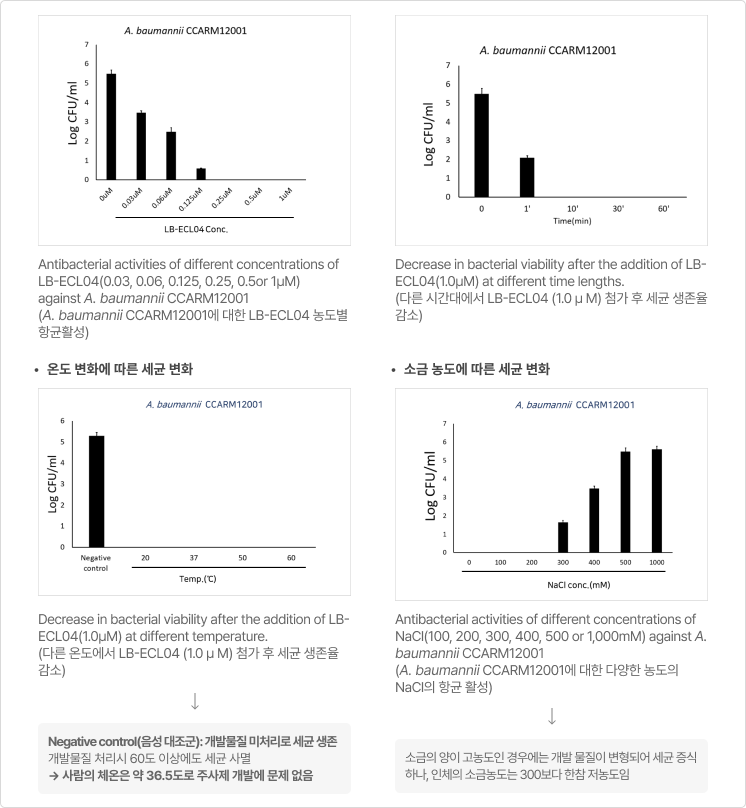
* Minimum inhibitory concentrations and minimum bactericidal concentrations
of LB-ECL04 against E. coli strains and A. baumannii strains
(대장균 균주와 아시네토박터 바우만니 균주에 대한 LB-ECL04의 최소억제농도 및 최소살균농도)
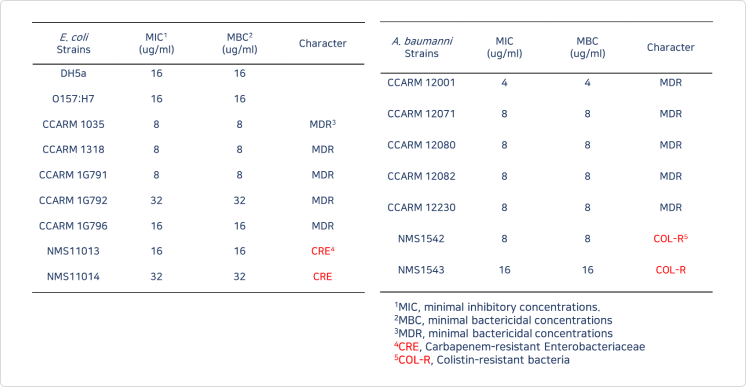
〔실험군 편성〕(Table) Experimental groups of Acinetobacter baumannii infected C57BL/6 mouse model
(아시네토박터 바우마니 감염 실험군 C57BL/6 마우스 모델)
1 A bacterial cell suspension of A. baumannii NMS 1542 was administered intraperitoneally at a dose of 7×107 CFU/200 μL per mouse as a single treatment
(A. 바우마니 NMS 1542의 박테리아 세포 현탁액을 단일 치료제로서 마우스당 7×107 CFU/200 μL의 용량으로 복강 내 투여함)
2 Treatment was administered subcutaneously 4 hours after the infection of A. baumannii. The novel recombinant protein drug, provided by LysinBio Corp. (Korea), was administered at high (2 mg/100 μL/mice, Infected + High-dose drug group) or low (1 mg/100 μL/mice, Infected + Low-dose drug group) doses as a single treatment.
(A. 바우마니 감염 4시간 후에 피하로 치료를 시행 - 리신바이오에서 제공한 새로운 재조합 단백질 약물을 고용량(2mg/100μL/감염된 고용량 약물 그룹) 또는 저용량(1mg/100μL/감염된 저용량 약물그룹)으로 투여
〔평가항목〕
- 생존율 평가
- 장기 내 A. baumannii 생균수 정량 평가
- 간 내 A. baumannii 정량 평가
- 비장 내 A. baumannii 정량 평가
- 신장 내 A. baumannii 정량 평가
- 폐 내 A. baumannii 정량 평가
❶ 생존율 평가 (Survival rates in a mouse infection model of A. baumannii)

❷ 장기 내 A. baumannii 생균수 정량 평가
<간 내 A. baumannii 정량 평가>
- log CFU/Liver g in a mouse infection model of A. baumannii

1 Viable counts of A. baumannii in the liver, measured either at the point of death or upon euthanasia at the end o fthe experiment were depicted. Data were expressed as mean ± standard error.
(사망 시점 또는 실험 종료 후 안락사 시 측정된 간 내 A.바우마니의 생존 가능한 수/ 데이터는 평균 ± 표준오차로 표현됨)
Different superscript letters indicate the statistical differences determined by analysis of variance (ANOVA;P<0.05).
(서로 다른 위첨자는 분산분석을 통해 결정된 통계적 차이를 나타냄)
<비장 내 A. baumannii 정량 평가>
- log CFU/Spleen g in a mouse infection model of A. baumannii

1 Viable counts of A. baumannii in the spleen, measured either at the point of death or upon euthanasia at the end of the experiment were depicted. Data were expressed as mean±standard error.
(사망 시점 또는 실험 종료 후 안락사 시 측정된 비장 내 A.바우마니의 생존 가능한 수/ 데이터는 평균 ± 표준오차로 표현됨)
Different superscript letters indicate the statistical differences determined by analysis of variance (ANOVA;P<0.05).
(서로 다른 위첨자는 분산분석을 통해 결정된 통계적 차이를 나타냄)
<신장 내 A. baumannii 정량 평가>
- log CFU/Kidney g in a mouse infection model of A. baumannii

1 Viable counts of A. baumannii in the kidney, measured either at the point of death or upon euthanasia at the end of the experiment were depicted. Data were expressed as mean ± standard error.
(사망 시점 또는 실험 종료 후 안락사 시 측정된 신장 내 A.바우마니의 생존 가능한 수/ 데이터는 평균 ± 표준오차로 표현됨)
Different superscript letters indicate the statistical differences determined by analysis of variance (ANOVA;P<0.05).
(서로 다른 위첨자는 분산분석을 통해 결정된 통계적 차이를 나타냄)
<폐 내 A. baumannii 정량 평가>
- log CFU/Lung g in a mouse infection model of A. baumannii

1 Viable counts of A. baumannii in the lung, measured either at the point of death or upon euthanasia at the end of the experiment were depicted. Data were expressed as mean ± standard error.
(사망 시점 또는 실험 종료 후 안락사 시 측정된 폐 내 A.바우마니의 생존 가능한 수/ 데이터는 평균 ± 표준오차로 표현됨)
Different superscript letters indicate the statistical differences determined by analysis of variance (ANOVA;P<0.05).
(서로 다른 위첨자는 분산분석을 통해 결정된 통계적 차이를 나타냄)
4. 장출혈성 대장균(EHEC) 감염증
① 개발의 필요성
- 장출혈성 대장균(EHEC: Enterohemorrhagic E. coli)는 HUS 유발 위험으로 기존의 항생제 사용이 권장되지 않으며 새로운 기작의 신규 항생제가 필요한 실정임
- 시가(Shiga) 독소를 생성하는 장출혈성 대장균 감염에 의하여 출혈성 장염을 일으키는 질환으로 용혈성 요독증후군(HUS)과 같은 합병증을 일으킴
- 감염병 구분: 제2급 법정 감염병
(구. 1군 법정 감염병) - 5세 이하 어린이의 경우 HUS 진행 시 치명률 높음
- 독소가 혈류를 타고 혈관 내피 세포를 침범하여 발생
- 전체 환자의 약 10%
- 급성신부전: 25%에서 만성 후유증(소아 신부전의 가장 큰 원인)
- 사망 혹은 말기 신장병 발생 위험 12%
 장출혈성 대장균(EHEC)
장출혈성 대장균(EHEC)

* 용혈성 요독증후군(HUS)
※ (참고) 장출혈성 대장균 발병 사례

- 유럽에서 22명이 사망하고 2,200명 이상이 감염된 대장균 집단 발병사태 발생
- 최소 10개국에서 사례가 발생하였고 600명 이상이 중환자실에 입원
* 처음에는 스페인에서 재배된 오이를 원인으로 조사했으나 검사결과 스페인산 오이에는 위험 균주가 포함되지 않은 것으로 나타남
* 독일의 한 농가에서 채취한 콩나물을 검사 했으나 첫 번째 검사에서는 오염이 발견되지 않음
→ 농가에 막대한 피해

- 안산 유치원생 햄버거 섭취 후 전체 원생 184명 중 100명 식중독 증상, 이중 14명 햄버거병 증상, 5명은 투석 치료
* 햄버거의 덜익힌 소고기나 오염된 채소 등을 섭취하여 발생(주로 여름철 발생)
* 세계적으로 매년 환자 2만명 발생, 200명 사망
② EHEC 처치를 위한 eLBP system 개발
〔실험군〕Experimental groups of E. coli O157 infected C57BL/6 murine model
(대장균 O157 감염 C57BL/6 쥐 모델 실험군)

1 The mice were given 5 g/L of streptomycin ad libitum for 3 days to deplete facultative intestinal flora, which allowed easily infection of E. coli O157. Water bottles were placed everyday with freshly prepared water.
쥐들에게 통성 장내 세균총을 고갈시키기 위해 3일 동안 스트렙토마이신 5g/L를 임의로 투여하여 E. coli 0157의 감염이 쉽게 되도록 함(물병은 매일 새로 준비한 것으로)
2 Each pre-treatment were given by LysinBio corp. (Korea). Each pre-treatment were administered orally using a gastric sonde once daily for 1 week.
각 전 처리는 1주일 동안 매일 한 번 위음향을 사용하여 경구 투여(by 리신바이오)
3 The bacterial cell suspension of E. coli O157 was prepared and administered orally using a gastric sonde (1.5 x 1010 CFU/200 μL/mice, once daily for 3 days). After the infection of E. coli O157, mitomycin C was injected intraperitoneally at a dose of 0.25 mg/kg to the infected mice three time every 3 h starting from 18 h after oral inoculation of E. coli O157.
대장균 O157의 세균 세포 현탁액을 준비/3일에 한번씩 경구 투여, 대장균 O157 미토마이신 C 감염 후 0.25 mg/kg의 용량으로 복강 내 주사, 감염된 쥐에게 O157 대장균을 경구 접종한 후 18시간부터 3시간마다 세 번씩 투여
4 Each treatment were given by LysinBio corp. (Korea). Each treatment were administered orally using a gastric sonde once daily for 2 weeks.
각 치료제를 2주 동안 매일 한 번씩 경구 투여(by 리신바이오)
〔평가항목〕
- 생존율
- 분변 내 E. coli O157:H7 정량 평가
- 마우스 체중 평가
- 주요 장기 변화 여부
- 간 중량 측정, 비장 중량 측정 - 혈액검사
❶ 생존율
- Endolysin secretion system을 섭취한 실험군(Drug C)에서 기존 항생제 섭취 실험군 이상의 생존율 확인

❷ 분변 내 E. coli O157:H7 정량 평가
<‘log CFU/fecal g’ on End-point of Experiment>
(* 실험 종료 시점의 ‘log CFU/배변 g’)
- Endolysinsecretion system을 섭취한 실험군(Drug C)에서 세균 검출 안됨

❸ 마우스 체중 평가
<‘Body weight’ of dead mice on End-point of Experiment>
(* 실험 종료 시점에서 죽은 쥐의 체중)
- Endolysin secretion system을 섭취한 실험군(Drug C)에서 유의적으로 체중이 증가됨을 확인

❹ 주요 장기 변화 여부
- E. coli O157:H7 감염 시 간과 비장의 크기는 shiga 독소분비 등의 이유로 병리학적으로 작아지는 경향이 나타남.
- Endolysin secretion system을 섭취한 실험군(Drug C)에서 간과 비장의 중량은 non-infected 실험군과 유사한 경향을 나타냄.
<‘Liver weight’ of dead mice on End-point of Experiment>
(* 실험 종료 시점에서 죽은 쥐의 간 무게)

<‘Spleen weight’ of dead mice on End-point of Experiment>
(* 실험 종료 시점에서 죽은 쥐의 비장 무게)

❺ 혈액검사
- Endolysin secretion system을 섭취한 실험군(Drug C)의 경우, 비감염 실험군과 비교하여 모든 항목에서 유사한 혈액검사 결과 수치가 확인됨.

5. CDI(장내 질병 관여균) 치료제


① 개발 필요성
〔기존 항생제 부작용〕
- 기존 치료법인 메트로니다졸, 반코마이신 등 항생제 투약은 고독성(hypervirulent) 균주에 의한 난치성 중증 CDI 치료 및 재발을 반복하는 CDI의 재발 치료는 부적절하기 때문에 효과적 치료법 개발 필요

〔기증자 분변 유래 마이크로바이옴 신약〕
* 출처: Global Industry Analysts, 2021 |
|
MOA(작용기전) 없음 |
⇣
 프로바이오틱스 투여 및 대변 이식 등 숙주의 미생물을 조절하는 일부 기술은 숙주에 심각한 부작용 유발 가능성이 있음
프로바이오틱스 투여 및 대변 이식 등 숙주의 미생물을 조절하는 일부 기술은 숙주에 심각한 부작용 유발 가능성이 있음
 〔리신바이오의 솔루션〕
〔리신바이오의 솔루션〕
- 합성생물학을 기반으로 한 마이크로바이옴의 치료 분야 응용성 확장하여
→ eLBPs 기반 정확한 작용기전을 갖는 경구용 CDI 치료제 개발 목표
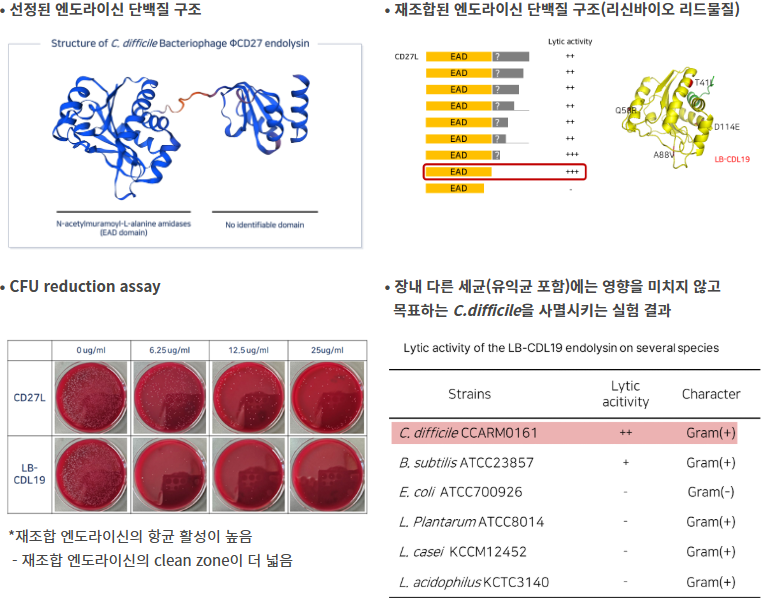
• 시간대별 세균수 감소
(LB-CDL19가 가장 효과 좋음)
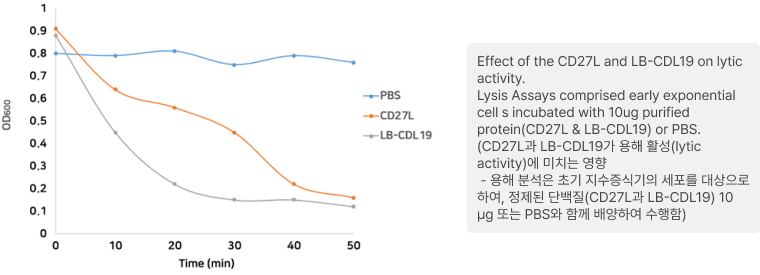
• ph와 온도 변화에 따른 구조
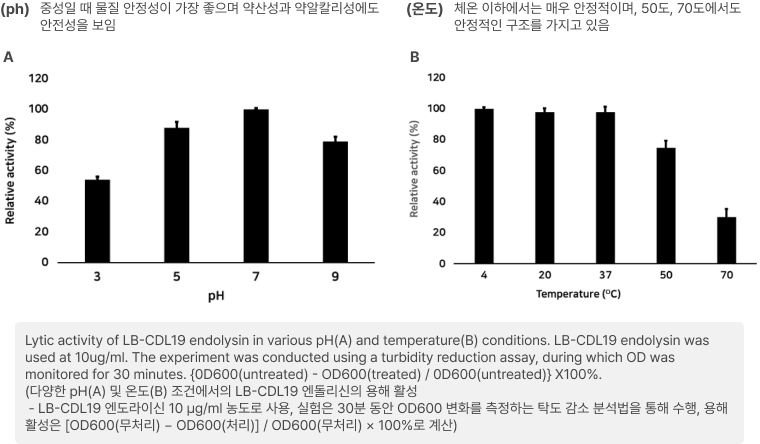
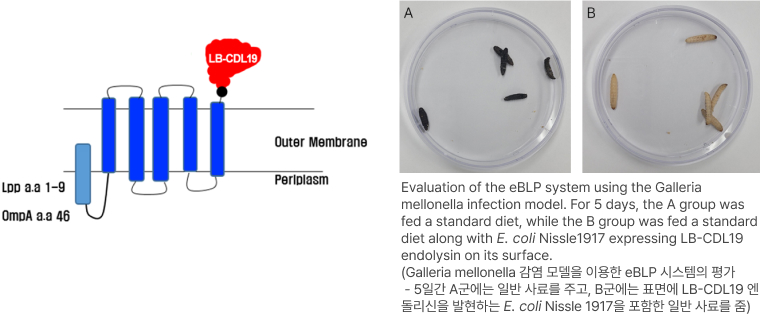
C. difficile을 타겟하는엔도라이신(LB-CDL19)의 E. coli Nissle1917 세포표면 발현 확인 및 Galleria mellonella infection model을 통한 유효성 확인
- 세포 표면 발현이 잘되었는지를 확인하기 위해 해당 엔도라이신에 형광물질을 입혀 현미경으로 찍은 사진 → 세포 표면 발현 확인
- Galleria mellonella infection model을 이용한 LB-CDL19의 유효성 확인
(좌측) 세균 감염후 당사 개발 물질 미처리로 부채명나방유충 사망
(우측) 세균 감염후 당사 개발 물질 경구 투입 후 부채명나방유충 생존
6. Anti-Obesity Drug(항비만, 항당뇨 치료제)

① 개발 필요성
〔비만시장〕
- 세계 최대 비만 치료 시장인 미국은 비만 유병률이 해마다 증가하고 있으며 매년 치료비용 발생 등으로 사회적 문제
- 2022년 기준, 미국 의료시스템 부담비용 연간 1730억$
- IQVIA는 2035년 미국 성인 비만율이 55%를 넘을 것으로 전망하고 비만 치료 시장 최대 성장 기대 - 전 세계 비만 시장 예측 (ref. IQVIA 2024)
- 2024년~2028년: 연 24~27% 성장하여 총 212% 증가 예상 - 전 세계 비만 시장 예측 (ref. 골드만 삭스 등 재인용)
- 2030년경에는 고혈압 치료제 시장에 버금가는 1,000억$(136조원) 규모로 성장 예측



〔비만치료제 개발현황〕
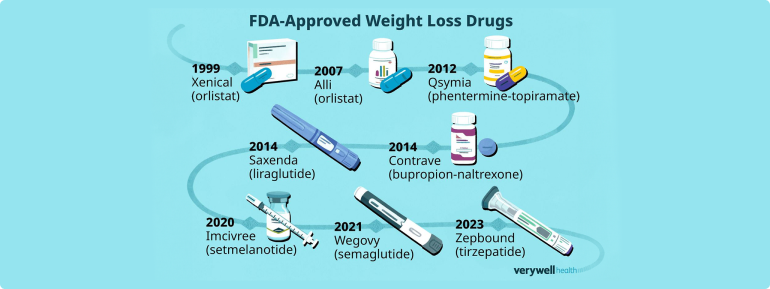
- 여러 비만치료제에서 부작용 발생으로 인한 시장 퇴출이 반복되면서 안전하고 장기간 투여가 가능한 약물에 대한 미충족수요가 높은 상황
- 글루카곤 유사 펩타이드(GLP-1) 비만치료제는 기존 비만 치료제 시장을 급속도로 대체
* FDA 승인 비만 치료제(ref. www.verywellhealth.com)
 GLP-1 작용기전
GLP-1 작용기전
❶ 인슐린 분비 증가
혈당 수치가 상승 → 췌장의 베타 세포에서 인슐린 분비 증가 → 혈당 저하
❷ 글루카곤 억제
췌장에서 글루카곤의 분비를 억제 → 간에서 포도당 생성 감소 → 혈당 수치 안정
❸ 식욕 억제
중추신경계에 작용하여 식욕을 감소, 포만감 증가 → 음식 섭취량이 감소, 체중 감소
❹ 위 배출 지연
위 배출 속도를 늦추어 장에서의 소화 시간을 연장 → 이로 인해 식사 후 오랜 시간 동안 포만감

※ 단점
혈중 반감기 2분 미만 → 이를 극복하기 위해 GLP-1 유사체 개발 및 상품화
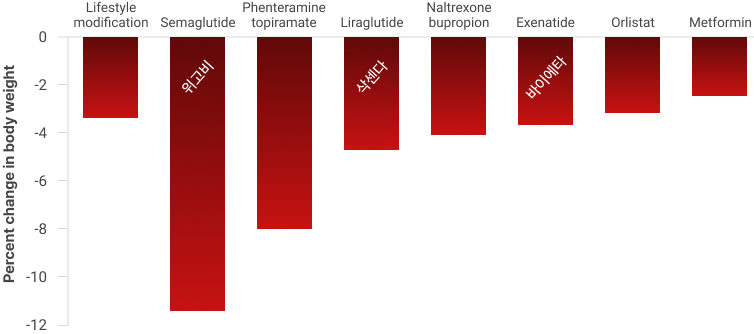
- 다양한 체중 감량 수단의 체중 변화(%) 비교 (ref. Barbieri. 2023)
② 개발 현황
〔국내 제약사와의 차별 포인트〕
- 당사 플랫폼기술 eLBP system을 적용하여 GLP-1 유사체를 발현하는 GRAS 미생물을 개발
→ 경구용 비만치료제로서 접근
 미생물에서의 발현가능하고 특허분쟁이 없는 GLP-1 유사체인 Exenatide를 GRAS 미생물인 효모 및 락토바실러스에서 secretion(분비)시킬 수 있도록 genetic engineerin(유전공학 - 생물의 DNA를 조작해 원하는 특성을 만들거나 기능을 바꾸는 기술)하여 eLBP 개발
미생물에서의 발현가능하고 특허분쟁이 없는 GLP-1 유사체인 Exenatide를 GRAS 미생물인 효모 및 락토바실러스에서 secretion(분비)시킬 수 있도록 genetic engineerin(유전공학 - 생물의 DNA를 조작해 원하는 특성을 만들거나 기능을 바꾸는 기술)하여 eLBP 개발
〔국내 제약사의 항비만 치료제 개발 현황〕
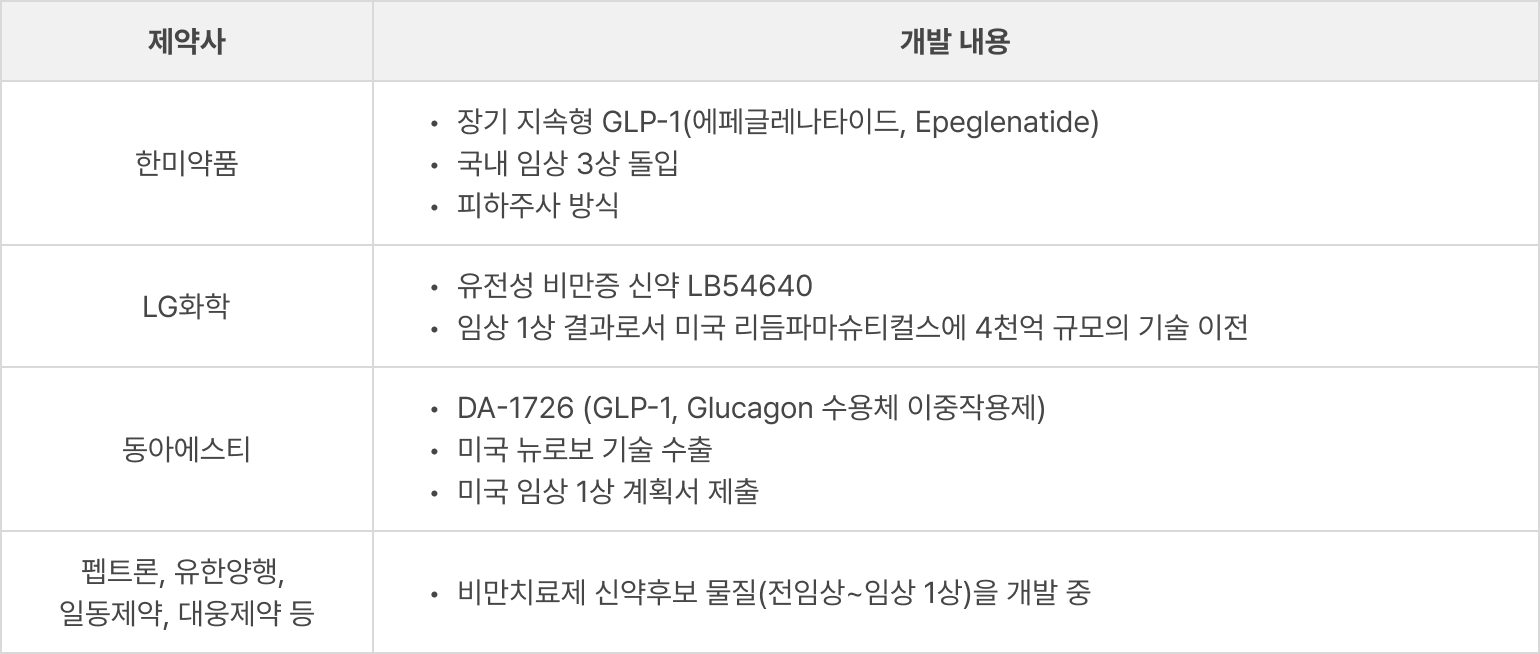
- 세포 발현

<효모 기반 GLP-1/GIP 균주 섭취 처리>

<효모 기반 GLP-1/GIP 균주 섭취 처리 결과>
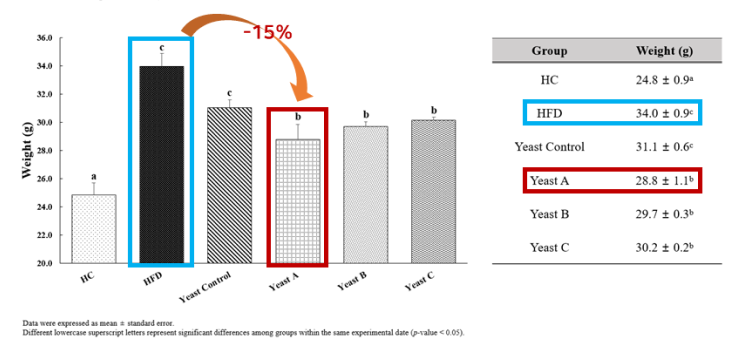
❶ 효모(균주) 처리 후 마우스의 체중 변화
- GLP-1 분비 발현 균주 섭취군에서 HFD군 대비 약 15% 체중 감소
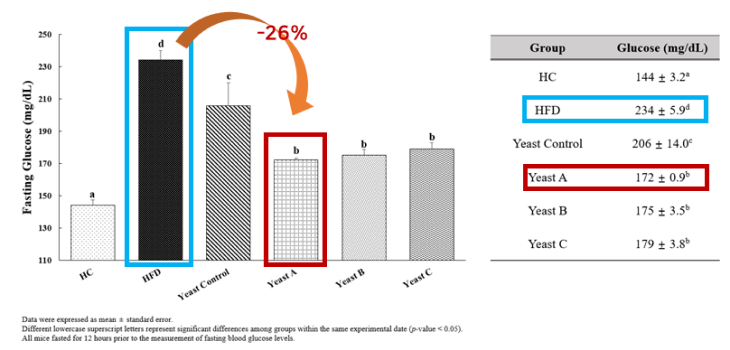
❷ 균주(효모) 처리 후 공복(단식) 상태에서의 혈당(포도당) 수치
- GLP-1 분비 발현 균주 섭취군에서 HFD군 대비 공복혈당 약 26% 감소
시장 규모
AMR(Antibiotic microbial resistance, 항생제 내성) 항생제 시장



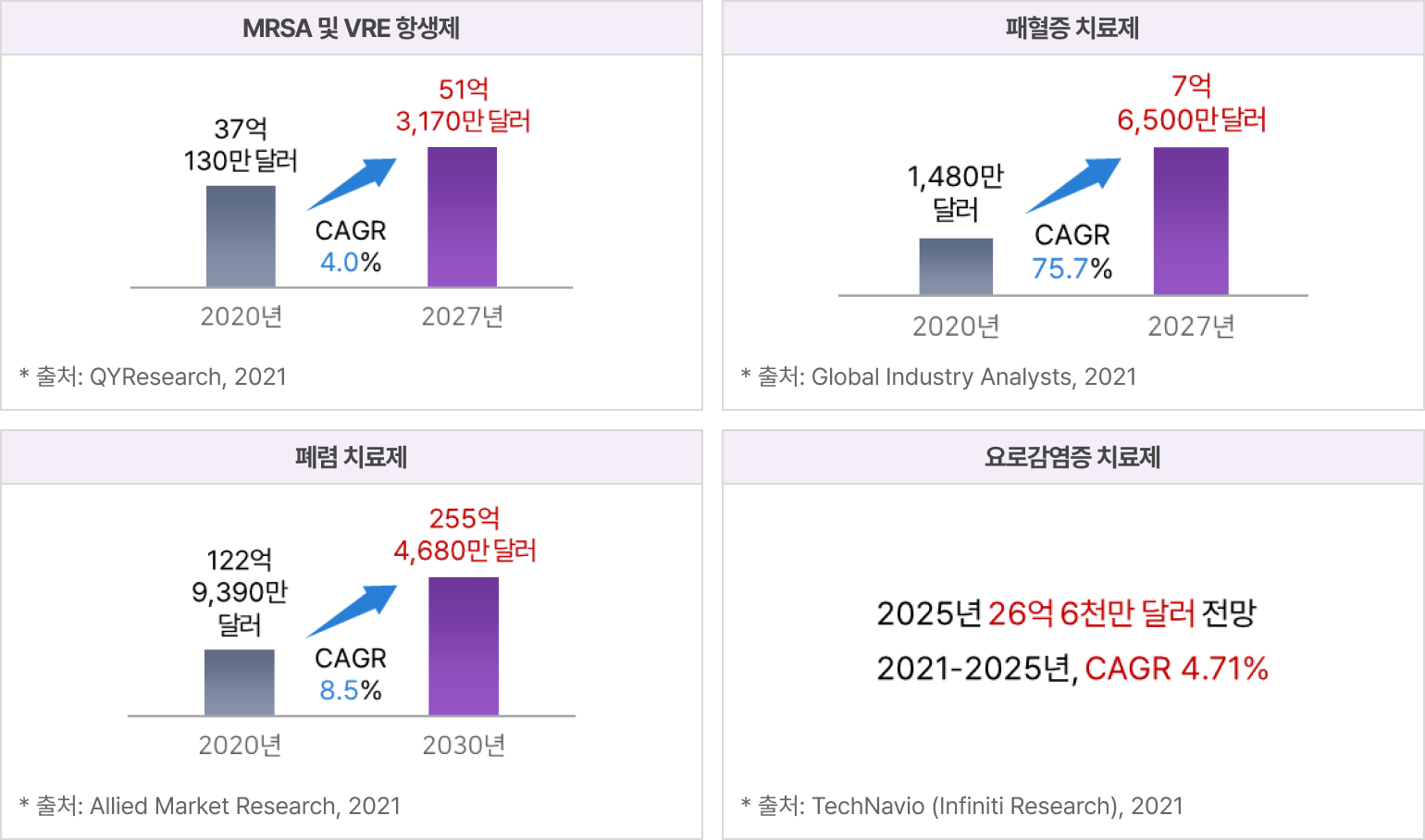
파이프라인의 적응증별 전세계 시장규모 및 전망
① eLBPs
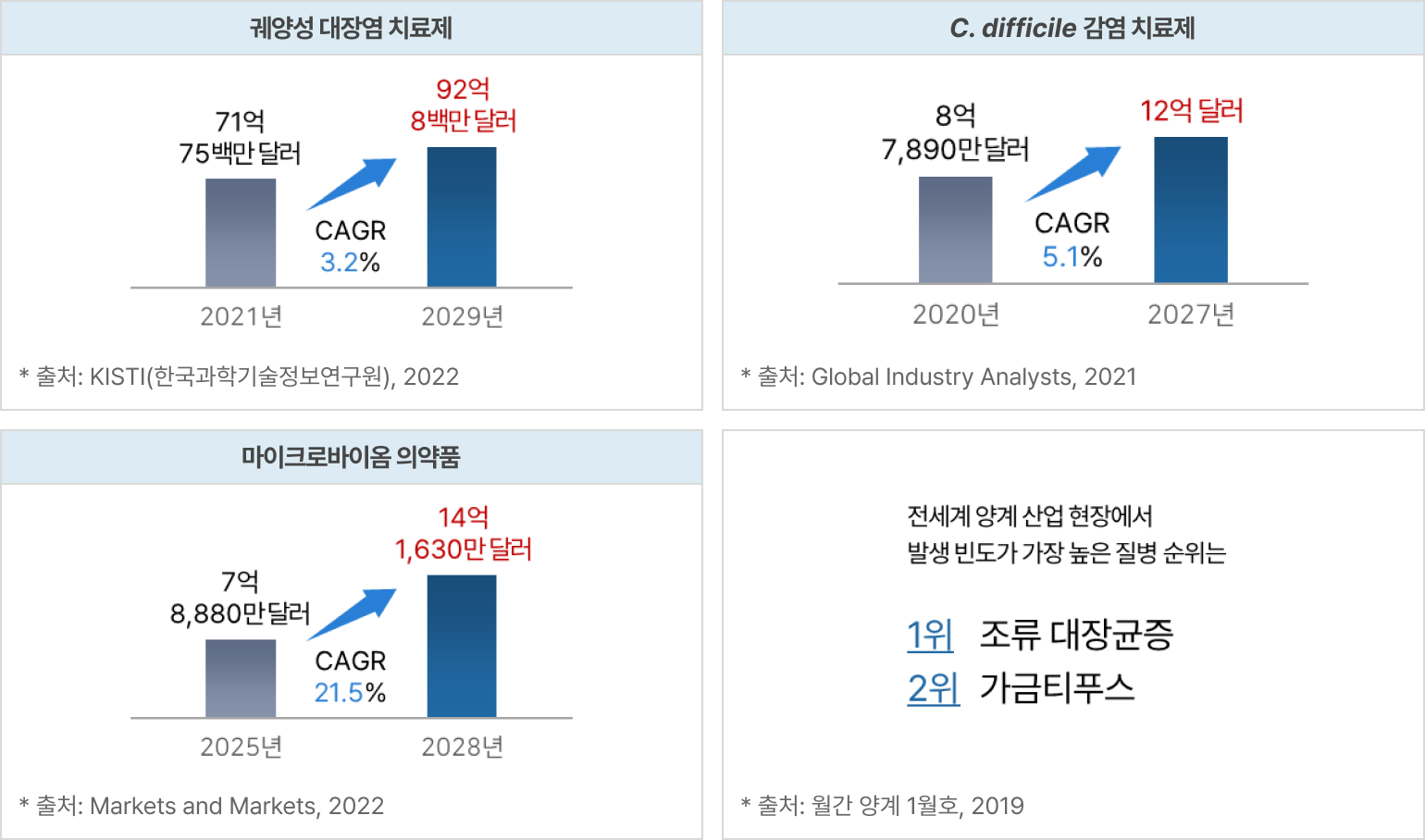
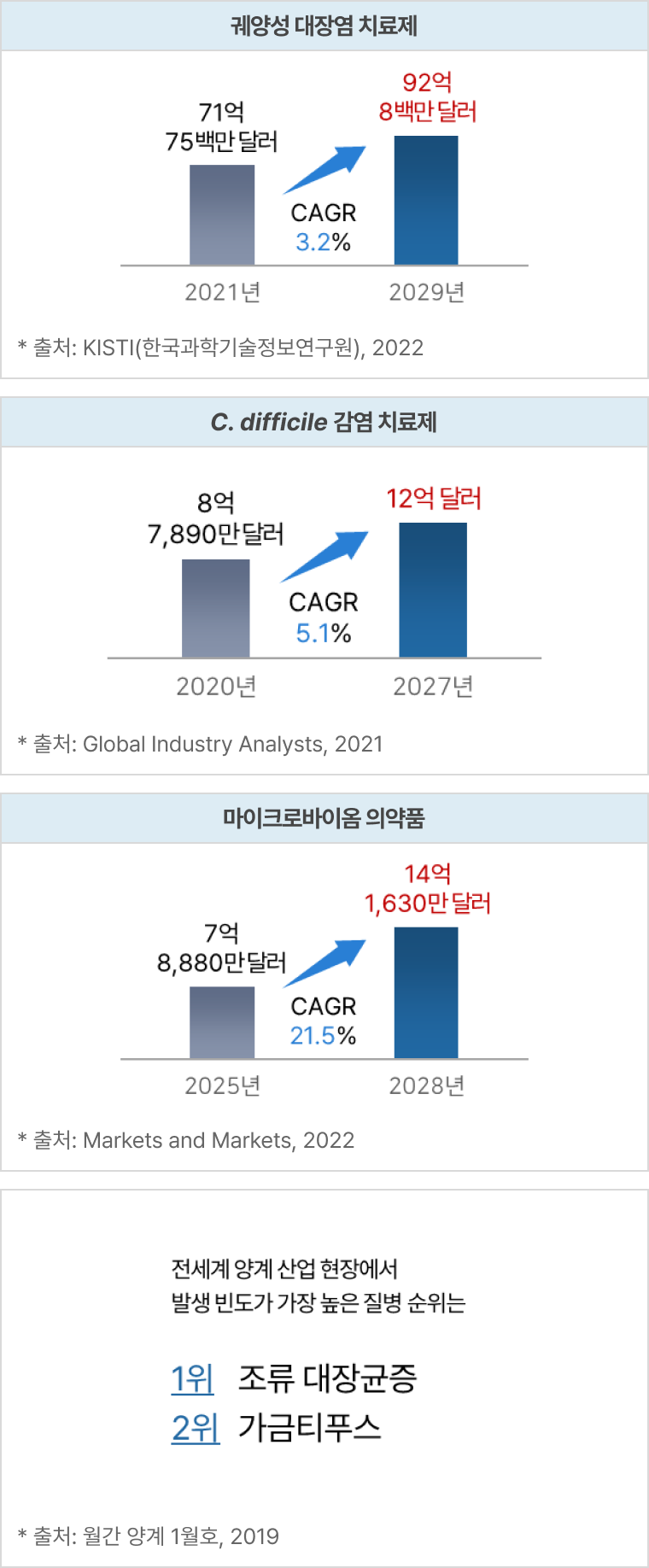
② 엔도라이신
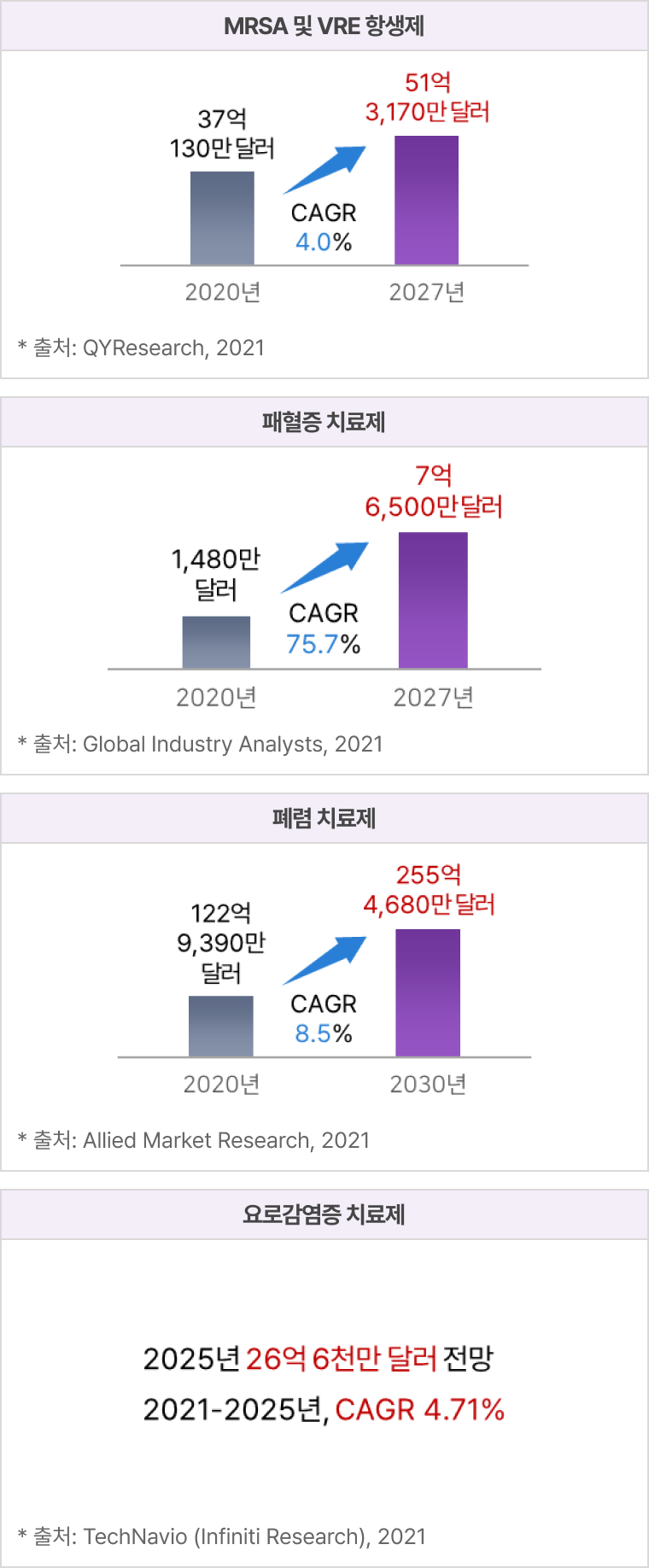
가축 보조사료
① 국내
- 시장 규모: 약 500억 규모로 추측
- 시장 동향


② 해외
- 시장 규모
- 시장 동향
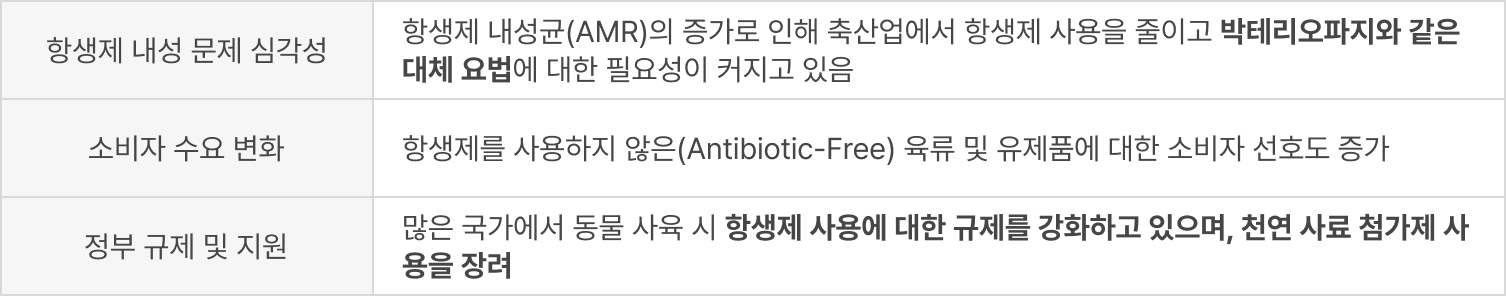
- 박테리오파지 사료 첨가제 시장은 2024년 기준 약 USD 663M에서 2033년까지 약 USD 1.99B 규모로 성장할 것으로 예상 (출처: Verified Market Reports)
여드름 화장품
① 국내
- 시장 규모: 2024년 기준 500억 규모, 지속적인 성장세
- 시장 동향 및 특징


② 해외
- 시장 규모
- 시장 동향
- Anti-Acne Cosmetics Market의 전 세계 시장 규모가 2024년 약 USD 5.2 B, 2030년까지 약 USD 8.9 B까지 성장할 것으로 전망(CAGR 9.4%)


창상 피복재
① 시장규모
- 국내: 3,500억정도 추산(2022년 기준)
- 해외: 2024년 기준 약 USD 5.05 B에서 2030년까지 약 USD 18.9 B(CAGR 5.3%) 규모로 성장할 것으로 예상
② 주요 성장 요인


아토피 화장품
① 시장규모
- 국내
- 해외
- 2024년 USD 13.49M, 2033년에는 약 USD 21.37M로 성장 예상(CAGR 약 5.17%).
(Deep Market Insights - Korea Eczema Skin-Care Products Market (2024 country insight).)
- 2024년 USD 2,930.6M, 2032년까지 약 USD 4,191.0M로 성장 전망 (CAGR 약 5.2%).
(Verified Market Research - Cosmetic Products (Emollients) In Atopic Dermatitis Market (2024).)
② 한국/아시아-태평양 지역의 시장동향 및 특징


수익모델
사업화 전략
(스타트업으로서) 기초연구부터 의약품 승인까지 모든 과정을 진행하는 전통적인 제약 기업과 달리 비임상 단계부터 국내 제약사 또는 글로벌 빅파마로의 기술이전을 통해 수익 창출
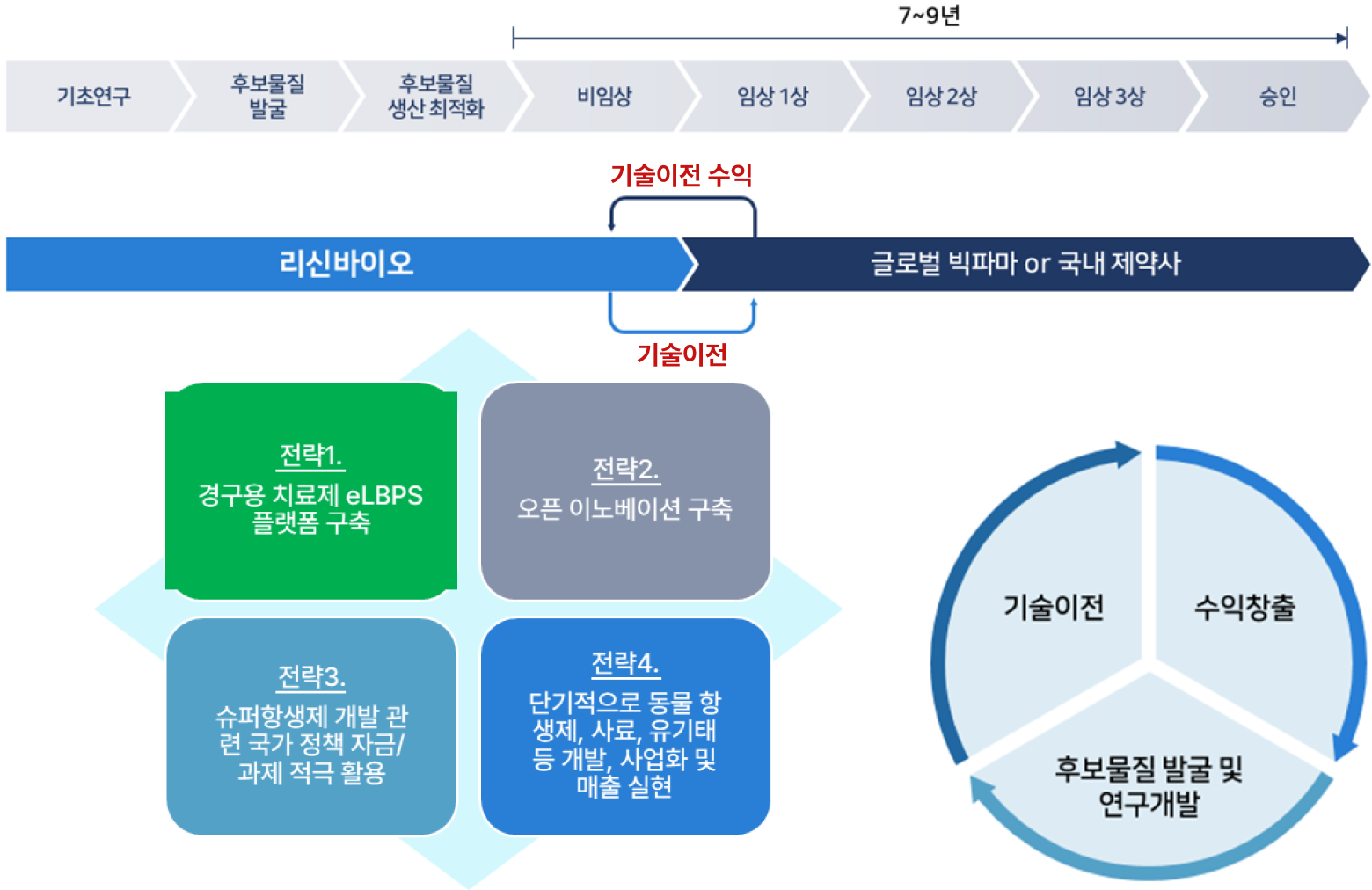
CASH COW 확보 전략
사업구조가 취약한 R&D 회사의 한계를 넘기 위해
❶ 인체용 신규 항생제 개발과 더불어 빠른 시장 진입이 가능한 가축 대상 항생제 대체제 개발 및 사업화
❷ 보조사료(미생물제), 유기태, 당사 플랫폼 기반 기능성 화장품 등의 개발 및 사업화 진행

가축 대상 의약품(항생제 대체제), 생균제 사업화, 인체용 의약품 대비 빠른 시간 내에 개발 및 사업화 가능
❶ eLBP 플랫폼 기술 기반 다양한 세균성 질환에 대한 제품 다각화
(예: 가금티푸스, 대장균증 등)
❷ 기 보유 중인 유익균, 유기태 생산기술 적극 활용
❸ 단기간 내에 제조 및 유통·판매망 구축 가능
<참고> 캐시카우 확보를 위한 MOU 체결

사업 성과
국내 및 해외 진출
① 국내
- 대한뉴팜㈜과 전략적 제휴를 통한 국내시장 진출
- 향후 가금류 뿐만 아니라 양돈 및 축우 대상 품목으로 확대
❶ 지분투자, ❷ 리신바이오 eLBP 기반 항생제 대체재 등 핵심 분야 공동 연구, ❸ 마케팅

② 해외
- 싱가포르 제약회사인 ‘자이로닉스’와 전략적 파트너십 체결
- 축산용 항생제 대체재 개발 추진
❶ 리신바이오 eLBP 기반 항생제 대체재 등 핵심 분야 공동 연구, ❷ 마케팅
※ 자이로닉스 측에서 가금티푸스(S. gallinarum) 제품 생산 관련하여 멕스코 Bachoco사 및 브라질 BR사에 제안


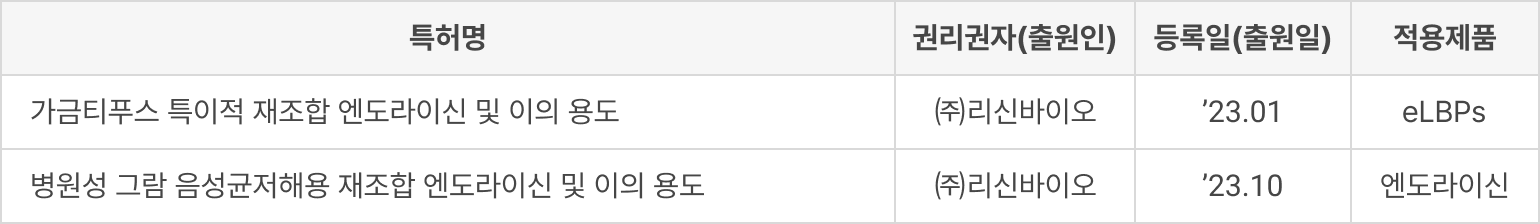
원천 기술에 대한 특허 보호, 파이프라인별 지식재산권 확보로 높은 진입장벽 구축
① 특허 등록
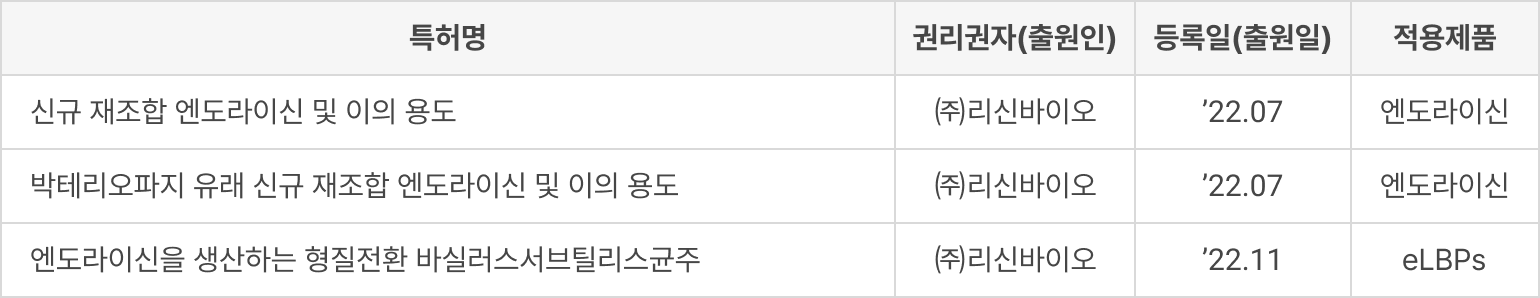
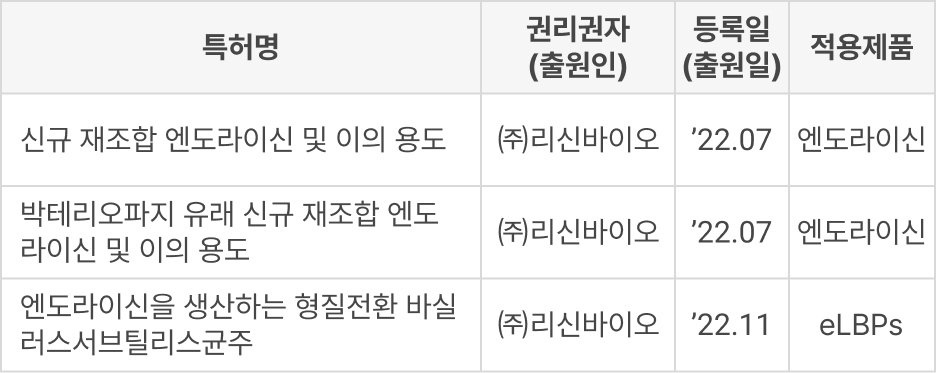
② 도입

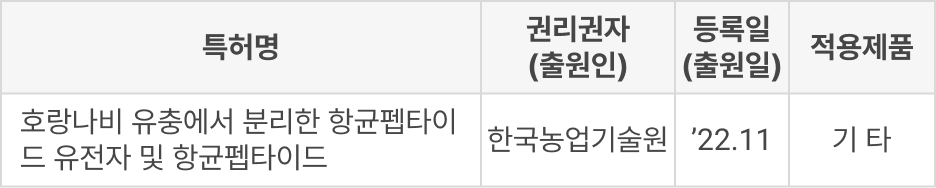
③ PCT 출원

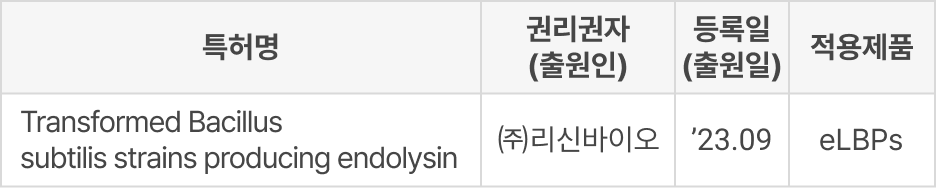
④ 출원

향후 사업 진행 계획
방향
다양한 치료 분야로 확장 가능한 ❶ 단백질 신약 DDS 플랫폼 eLBPs 적응증 확장 및 ❷ 지식재산권 추가 확보
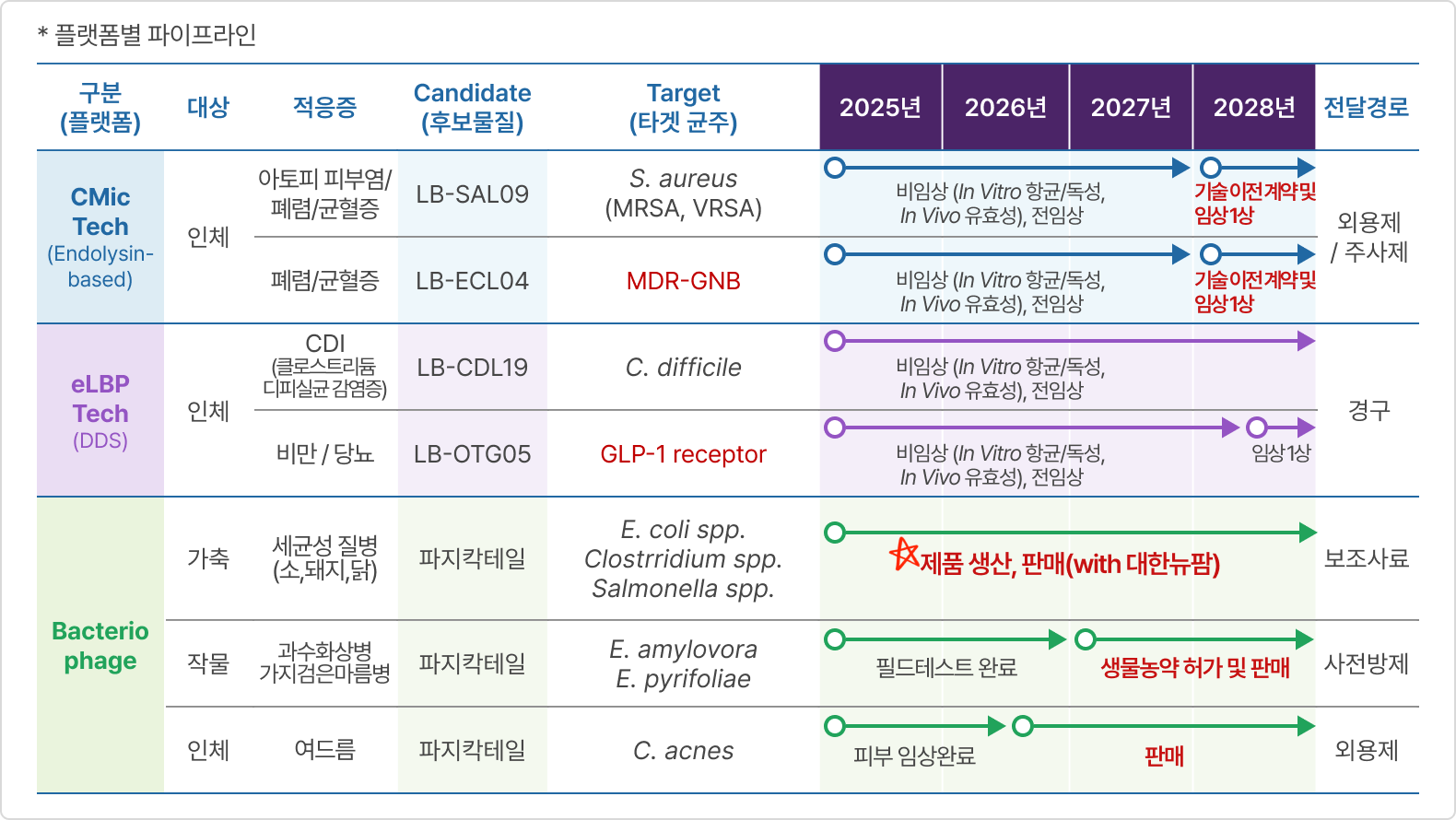
플랫폼별 파이프라인
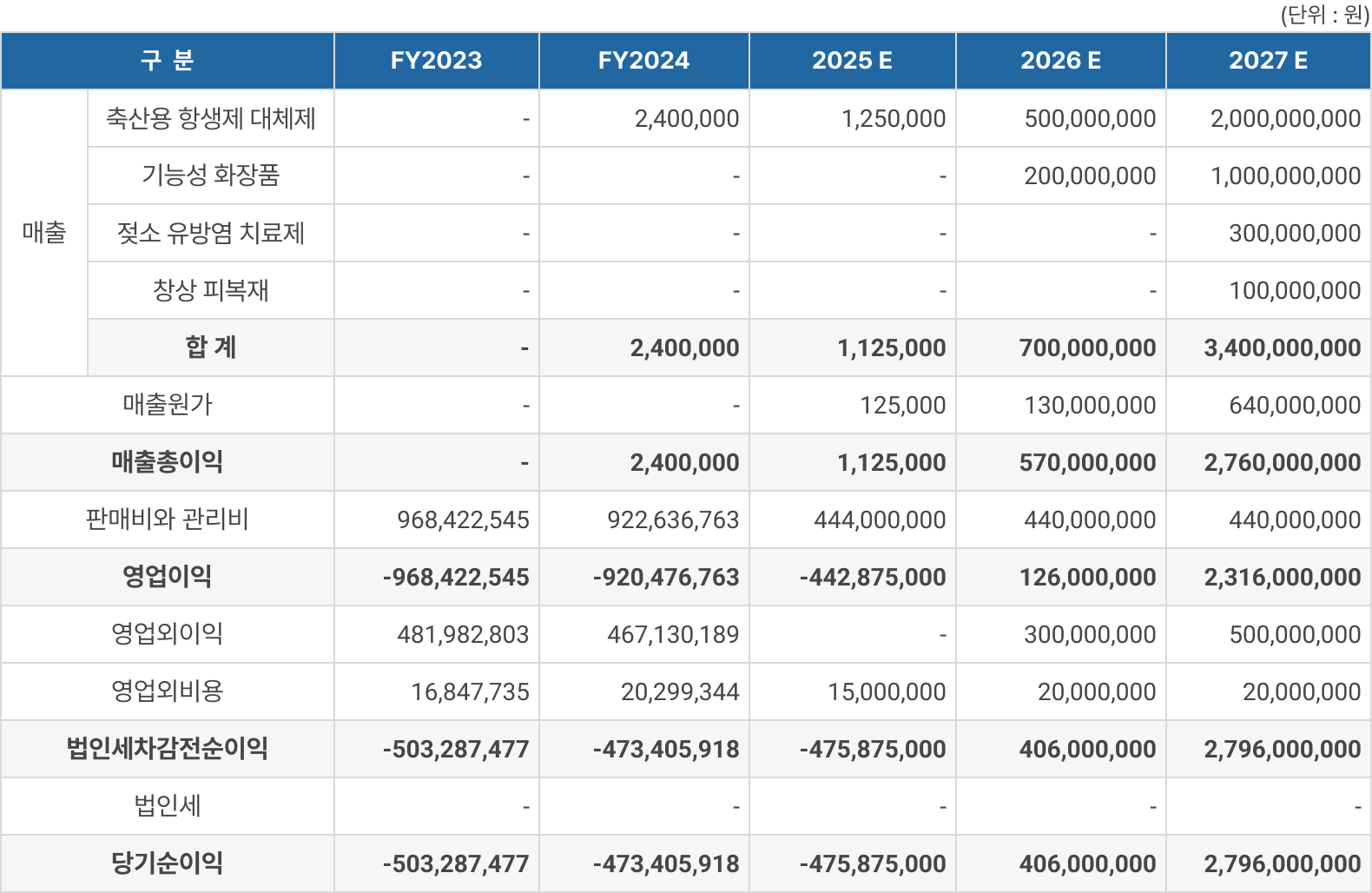
향후 5개년 추정 손익
손익계산서
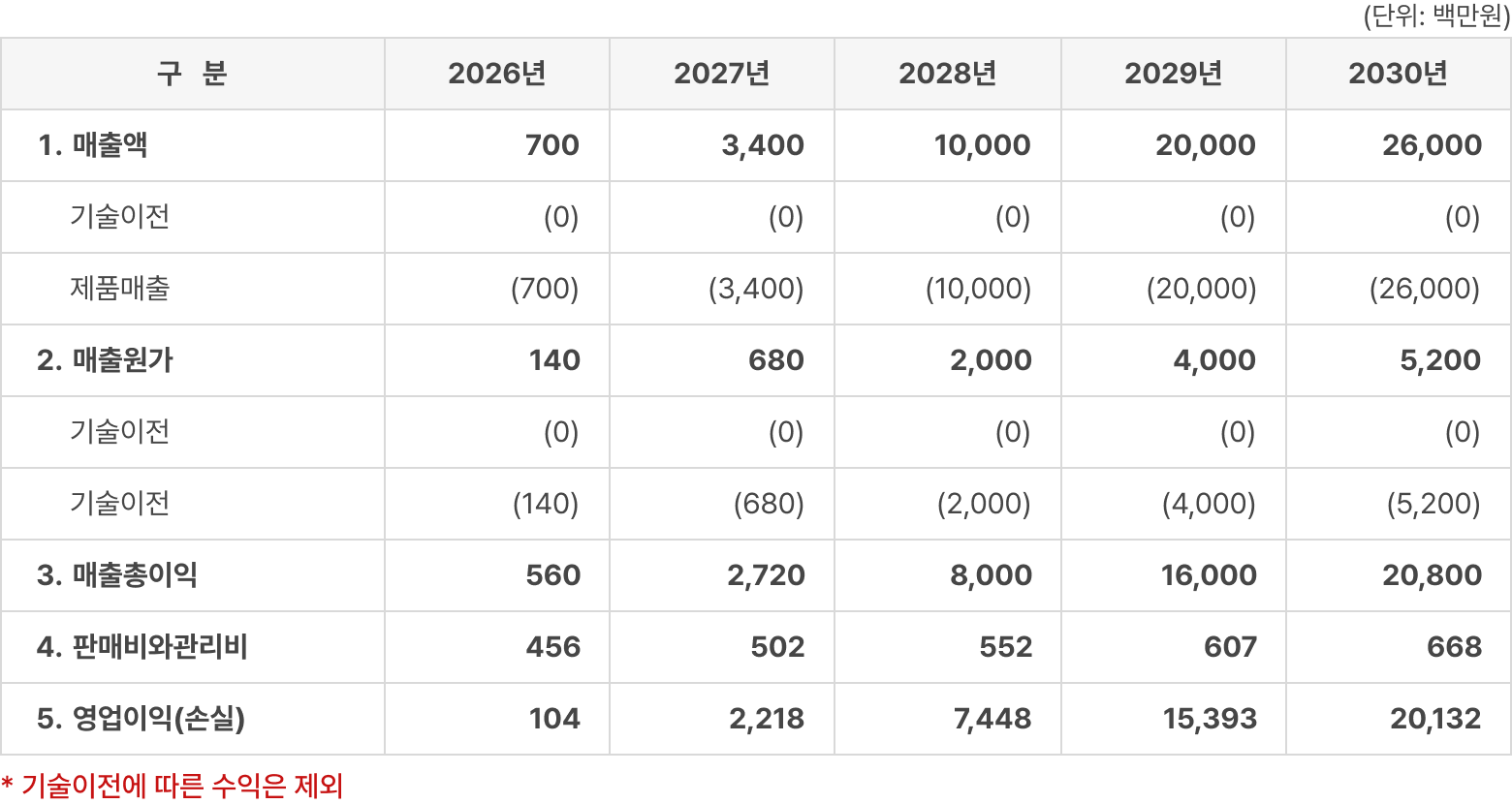
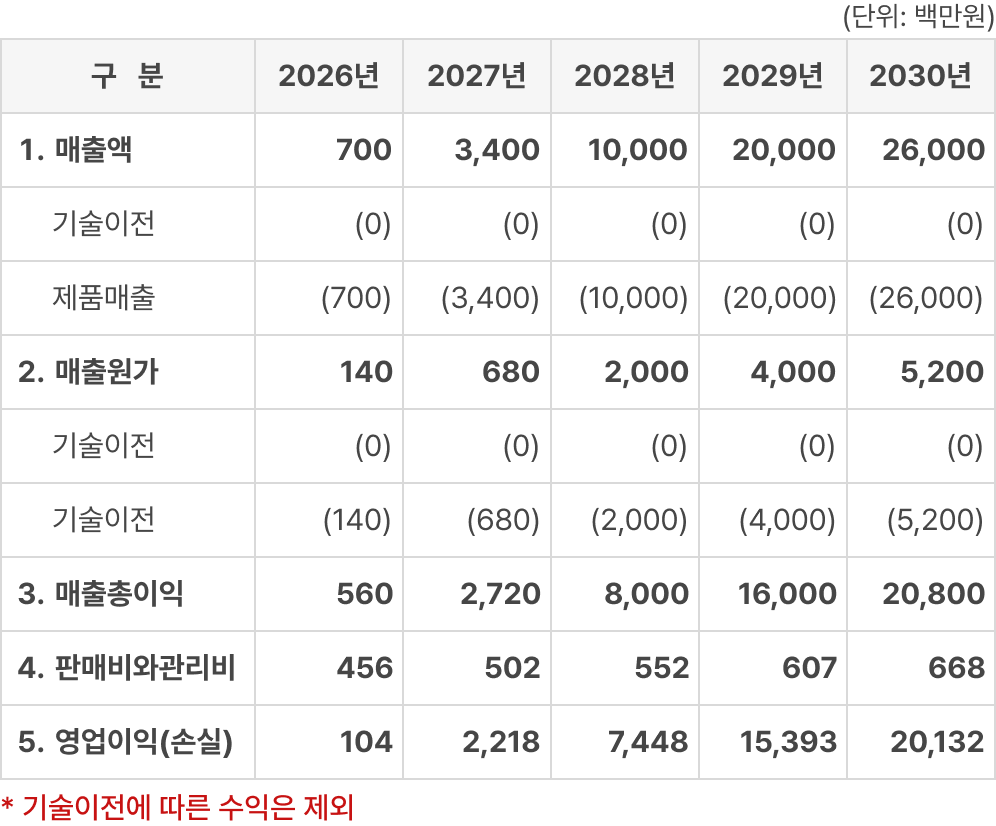
※ 매출 산출 근거
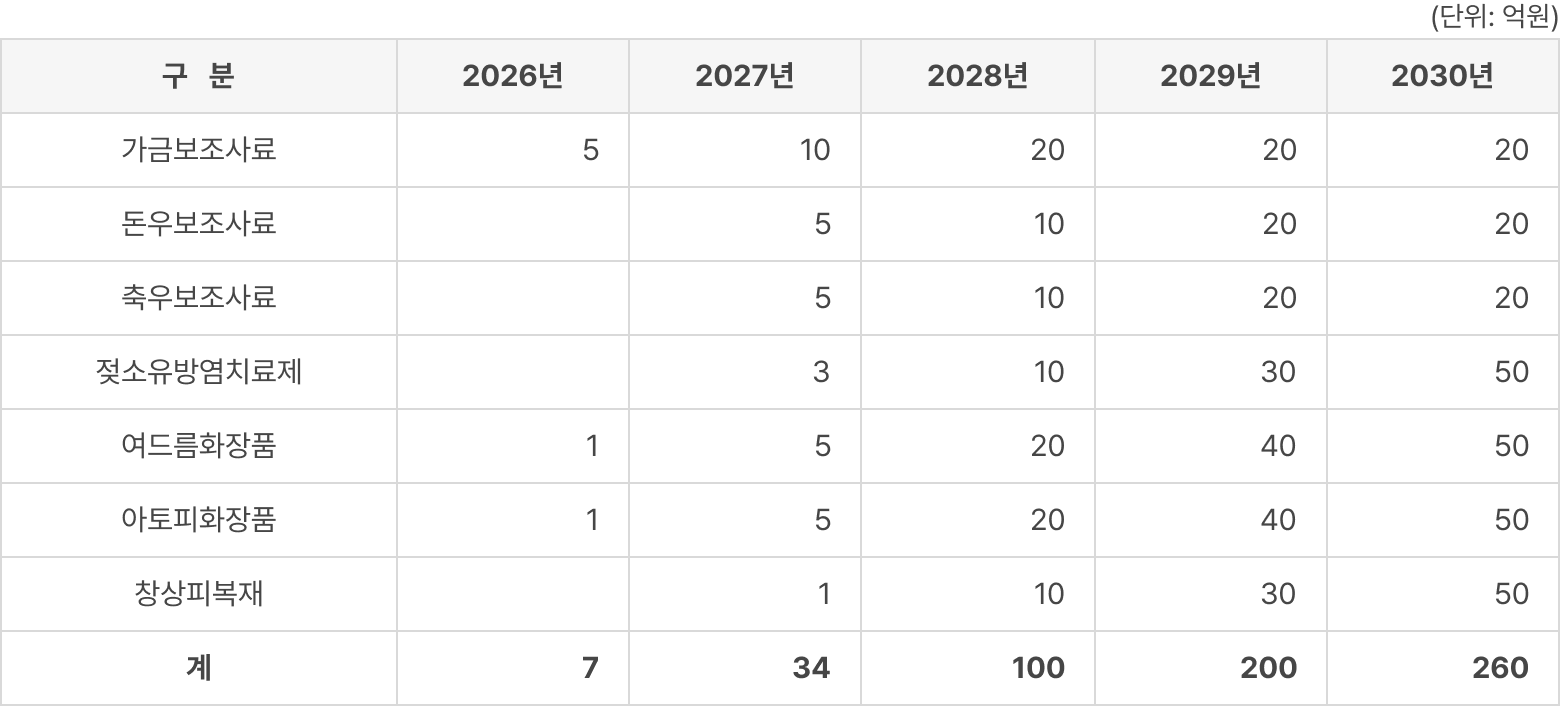
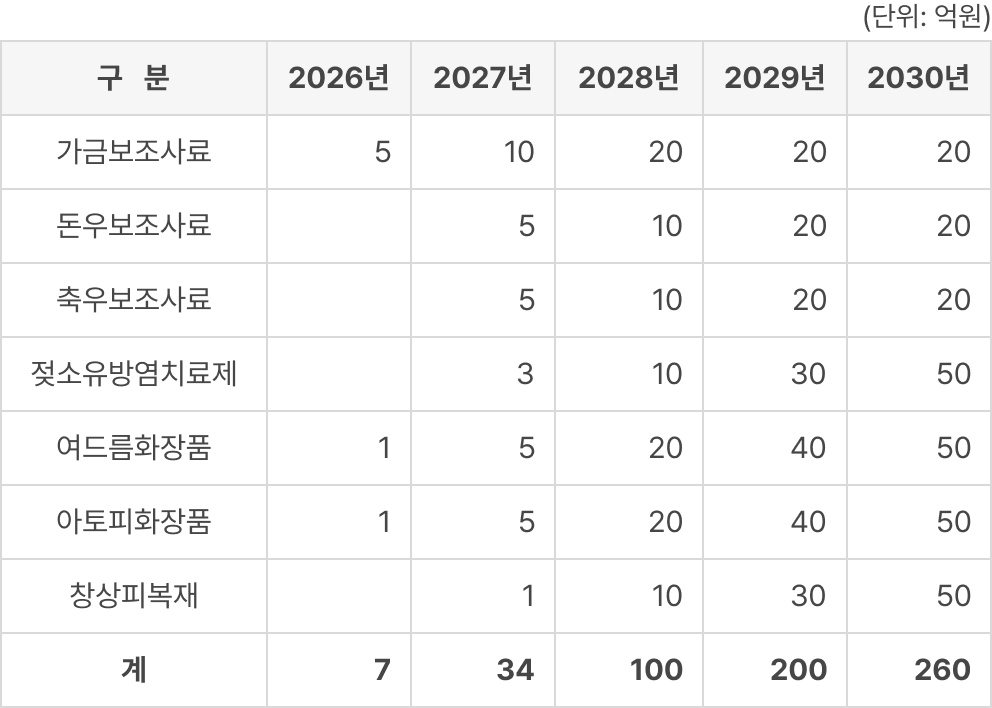
파이프라인의 적응증별 기술 이전 수익
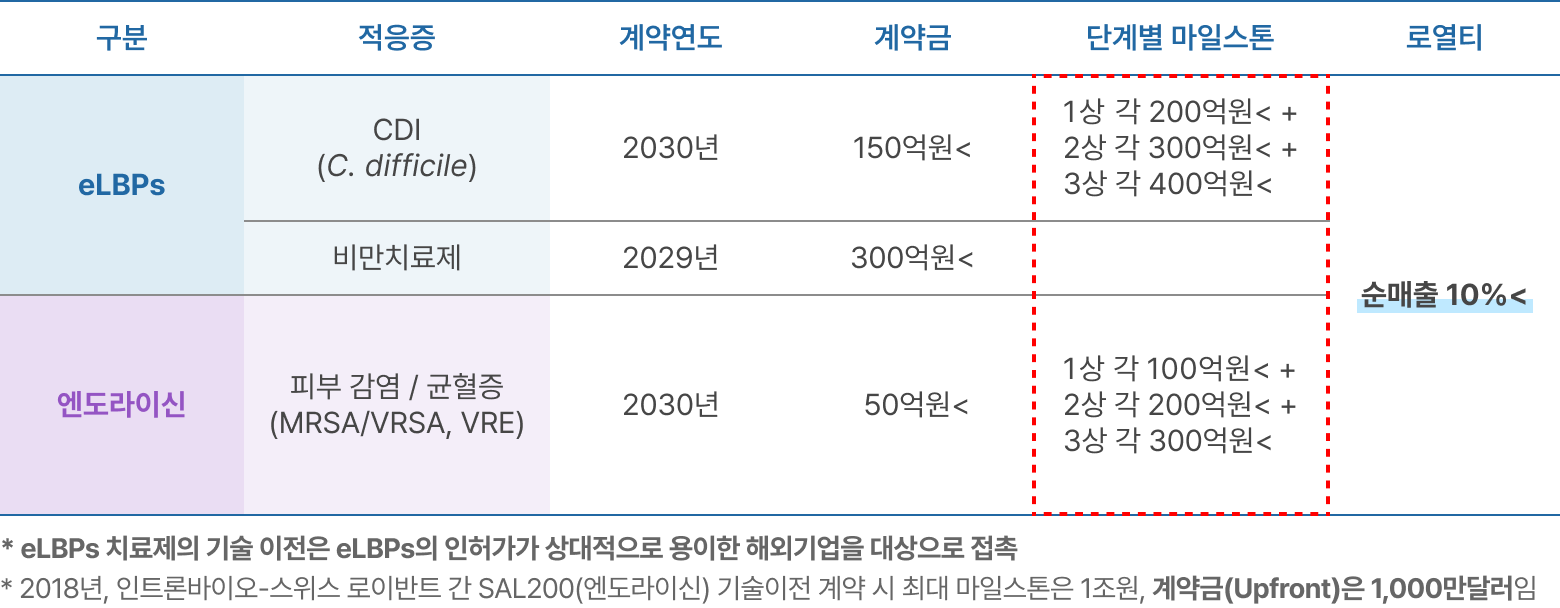
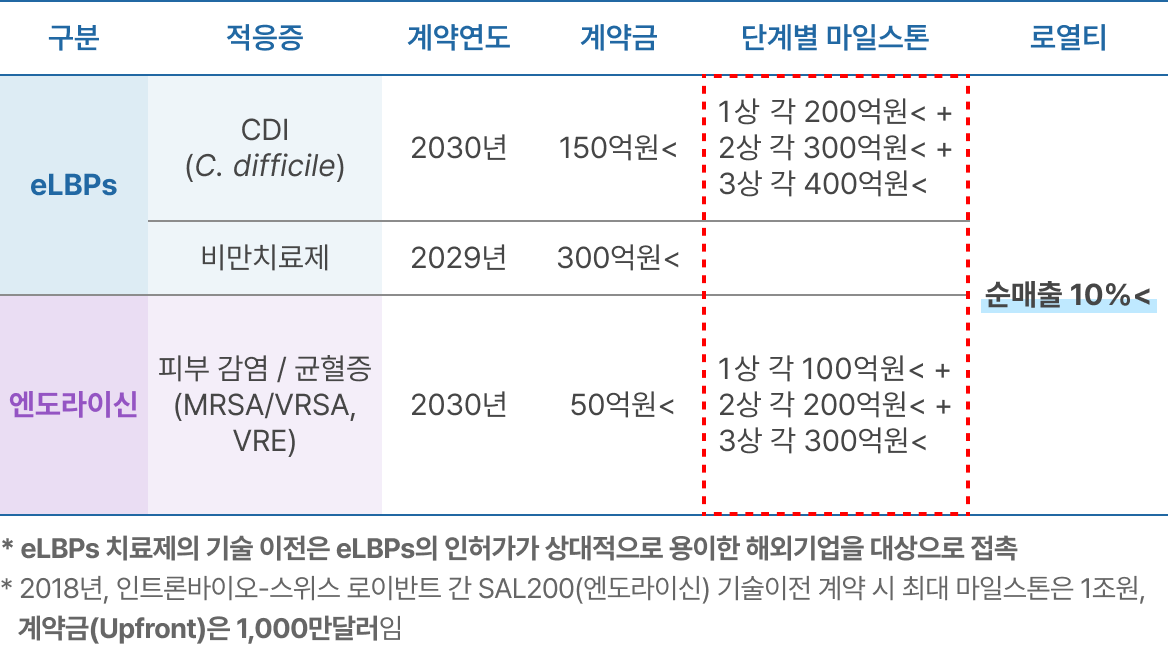
EXIT 전략
기업가치 및 산정 근거
❶ 기업가치
㈜리신바이오의 기업가치(Pre-money Valuation)는 11,356,695,000원(1주당 전환가액은 9,000원)으로 산정함.
❷ 산정 근거
㈜리신바이오의 ’23~’27년도 평균 매출(추정 포함)은 820백만 원이며, 현재 기업가치의 경우 ’25.10월 외부 투자유치 후 기업가치 10,094,840,000원(포스트밸류)와 아래 유사업체(비상장사)의 추정 기업가치를 참고함.
* 다제내성균 치료제 기업, ㈜마******** : ’25.08월 기준 200억 원(시리즈B) 투자유치 성공 후 기업가치 800억 원
※ <참고> 5개년 재무제표(추정 3개년 포함)
APPENDIX
회사 연혁


2차 크라우드펀딩(2025.02.03) 이후 성과
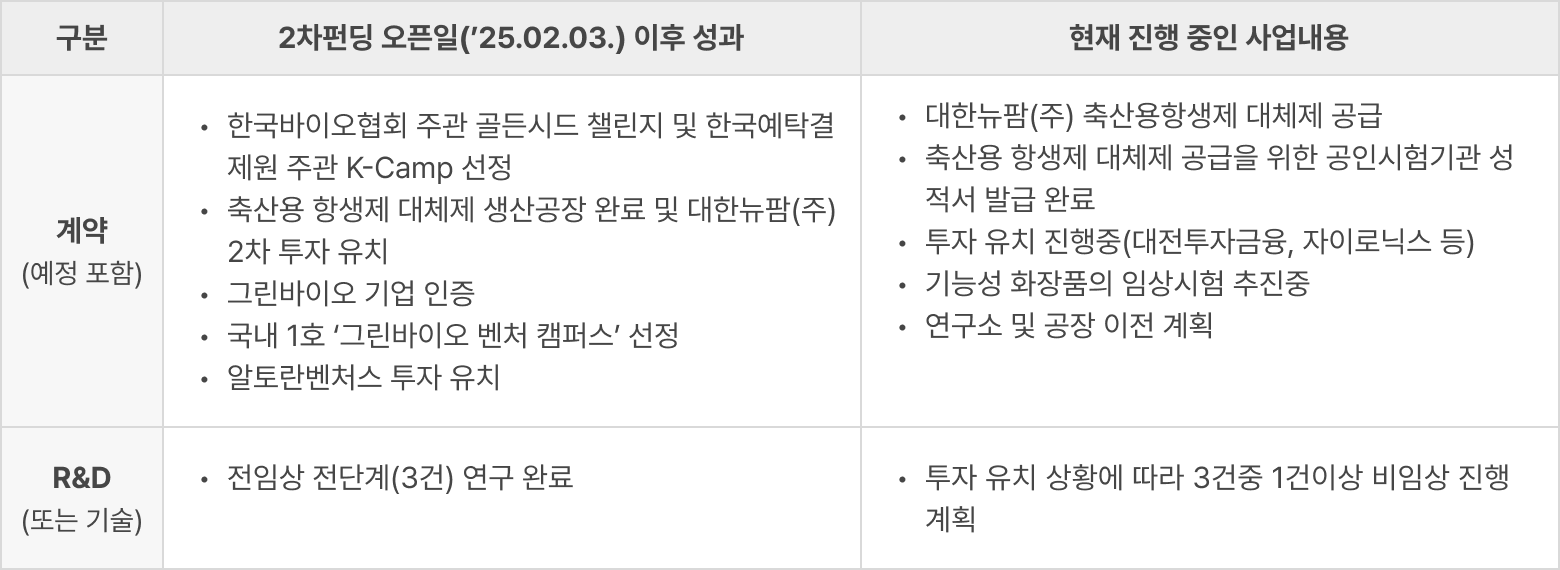
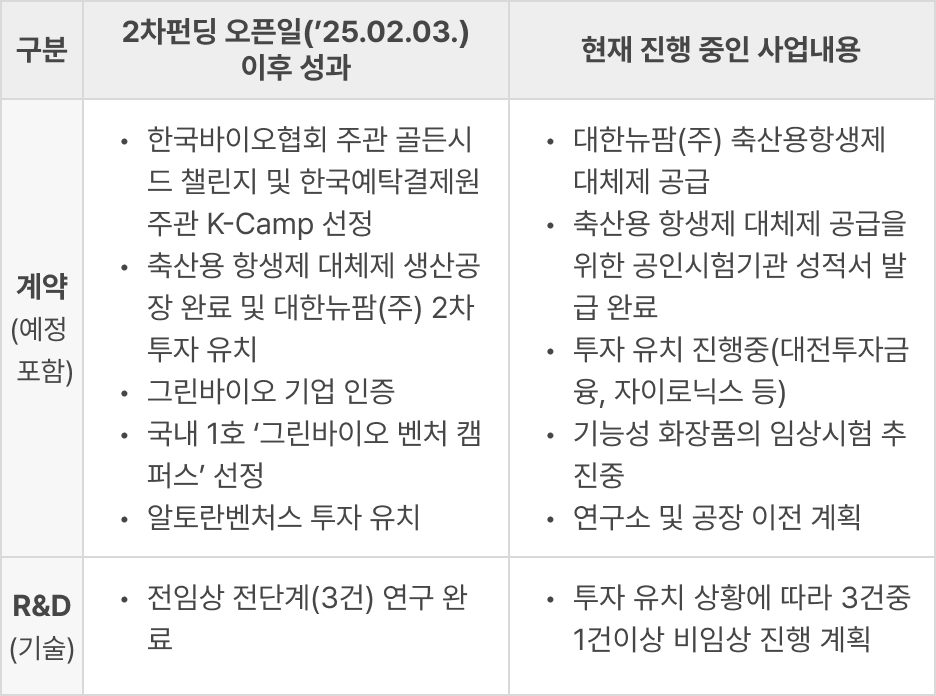
오피스 전경

(2026.01.20 펀딩포유측 현장 방문)
회사개요
회사개요는 본청약 오픈 시 공개됩니다.
재무상태
재무상태는 본청약 오픈 시 공개됩니다.
투자위험요소
투자위험요소는 본청약 오픈 시 공개됩니다.
자금사용목적
자금사용목적은 본청약 오픈 시 공개됩니다.
리워드 혜택
| 구 분 | 리워드 내용 |
|---|---|
|
오픈 첫날 투자 (금액별 리워드와 별개) |
|
|
사전예약하고 투자 (금액별 리워드와 별개) |
|
|
56 ~ 111구좌 투자 (504,000원 ~ 999,000원) |
|
|
112 ~ 333구좌 투자 (1,008,000원 ~ 2,997,000원) |
|
|
334 ~ 555구좌 투자 (3,006,000원 ~ 4,995,000원) |
|
|
556 ~ 1111구좌 투자 (5,004,000원 ~ 9,999,000원) |
|
|
1112 ~ 2222구좌 투자 (10,008,000원 ~ 19,998,000원) |
|
|
2223 ~ 3333구좌 투자 (20,007,000원 ~ 29,997,000원) |
|
|
3334구좌 이상 투자 (30,006,000원 이상) |
|
|
※ 펀딩포유 포인트몰은 다양한 상품을 할인된 가격으로 구매할 수 있는 펀딩포유 투자자를 위한 멤버십 서비스입니다. ※ 포인트는 증권입고일에 일괄 지급되며, 유효기간은 적립일로부터 24개월입니다. |
|
(주)펀딩포유는 「자본시장과 금융투자업에 관한 법률」제117조의4에 따라 등록승인된 온라인소액투자중개업자입니다.
(주)펀딩포유는 플랫폼 제공자로 자금을 모집하는 당사자가 아닙니다. 따라서 투자 손실의 위험을 보전하거나 리워드 제공을 보장해 드리지 않으며 이에 대한 법적인 책임을 지지 않습니다.
Copyright © 2019 funding4u. All rights reserved.





 문의신청
문의신청