신규항생제 합성생물학 기반 기술 기업, ㈜리신바이오
모집금액
100.6%
목표금액 (1차 증액)
150,003,000원최초 목표
50,001,000원
투자자
94명결과
성공청약기간
2024-05-20 ~ 2024-06-03
본 청약은 '투자'에 해당되는 것으로 원금 손실의 가능성이 있습니다. 투자 위험에 대한 안내를 꼭 확인해주세요.
증권 발행 조건
| 증권종류 |
상환전환우선주
 일정 조건에 따라 투자금 상환을 요청할 수 있는 상환권과 우선주를 보통주로 전환할 수 있는 전환권이 있는 주식입니다.
일정 조건에 따라 투자금 상환을 요청할 수 있는 상환권과 우선주를 보통주로 전환할 수 있는 전환권이 있는 주식입니다.
|
목표금액 | 150,003,000원 |
|---|---|---|---|
| 발행가액 | 7,000원 | 현재기업가치 | 8,120,917,000원 |
| 현재발행 주식수 | 1,160,131주 | 투자가능 최소수량 | 15주 |
| 발행예정 주식수 | 21,429주 | 청약기간 | 2024. 05. 20 ~ 2024. 06. 03 |
| 배정지분율 | 1.81% | 배정일 | 2024. 06. 13 |
| 배정방법 | 목표금액 내 선착순 배정 | 납입일 | 2024. 06. 14 |
| 명의개서 대리인 | 한국예탁결제원 | 발행일 | 2024. 06. 15 |
| 청약증거금 예치기관 | 신한은행 | 증권 입고일 | 2024. 07. 03 |
|
상환청구기간
 보유한 주식의 전부 또는 일부를 회사에게 상환 요청할 수 있는 기간입니다.
보유한 주식의 전부 또는 일부를 회사에게 상환 요청할 수 있는 기간입니다.
|
2027. 06. 15 ~ 2031. 06. 15 |
전환청구기간
 회사에게 보유한 우선주를 보통주로 전환 요청할 수 있는 기간입니다.
회사에게 보유한 우선주를 보통주로 전환 요청할 수 있는 기간입니다.
|
2027. 06. 15 ~ 2031. 06. 15 |
| 상환금리 | 연 단리 7% |
전환조건
 우선주식 1주당 회사가 제시한 비율을 적용한 수만큼의 보통주식으로 전환됩니다.
우선주식 1주당 회사가 제시한 비율을 적용한 수만큼의 보통주식으로 전환됩니다.
|
우선주 1주당 보통주 1주 |
|
최저배당이율
 주식의 액면가격 또는 발행가격 기준으로 회사가 제시한 이율을 적용한 금액을 우선 배당 받습니다.
주식의 액면가격 또는 발행가격 기준으로 회사가 제시한 이율을 적용한 금액을 우선 배당 받습니다.
|
액면금액의 2% |
1주당 전환가액
 보통주로 전환할 시에 적용하는 주식의 가격입니다.
보통주로 전환할 시에 적용하는 주식의 가격입니다.
|
7,000원 |
| 비고 | *상환권이 부여된 주식으로, 투자자는 발행일로부터 3년 후 이익잉여금 범위 내에서 연 단리 7%의 이자율로 상환 청구 가능. · 목표금액: 50,001,000원 → 150,003,000원('24.05.27) |
||
· 배정방법(목표금액 내 선착순 배정)에 따라 미배정 또는 일부 배정이 될 수 있으며, 배정되지 않은 청약금은 투자예치금 계좌로 환불(2024.06.12)됩니다.
투자포인트
- POINT 1부작용 낮고 반복 투여 주사가 불필요한 합성생물학 기반 유전자재조합 치료제 기술 개발 기업
- POINT 2비임상 단계 기술이전 및 가축 대상 의약품 개발로 수익성 확보(’27년 IPO 목표로 IBK증권과 주관사 계약 체결)
- POINT 3벤처인증기업으로 투자금액 전액 소득공제 적용
소득공제 계산기
연소득(과세표준)
원
투자금액
원
소득공제
|
소득공제액
 소득 공제율
소득 공제율3천만 원 이하 100% 3천만 원 초과 5천만 원 이하 70% 5천만 원 초과 30% |
0원 (투자금액의 0%) |
|
|---|---|---|
| 공제 전 | 공제 후 | |
| 과세표준 | 0원 | 0원 |
| 소득세액 | 0원 | 0원 |
| 절세금액 | 0원 | |
실질 수익(예상)
-
소득공제 혜택 (지방소득세 포함)
0원
-
투자금액 대비 수익률
0%
·소득공제 혜택은 소득의 유형(근로소득, 사업소득), 공제 항목 등에 따라 달라질 수 있습니다.
· 2023년 1월 1일자 소득세법 개정으로 '소득세 과세표준 구간'이 조정되었습니다.
투자핵심노트

프로바이오틱스 GRAS균주를 활용한 약물 전달체 플랫폼 구축으로
다양한 질환 치료의 새로운 패러다임을 제시합니다
프로바이오틱스 GRAS균주를 활용한
약물 전달체 플랫폼 구축으로
다양한 질환 치료의 새로운 패러다임을 제시합니다
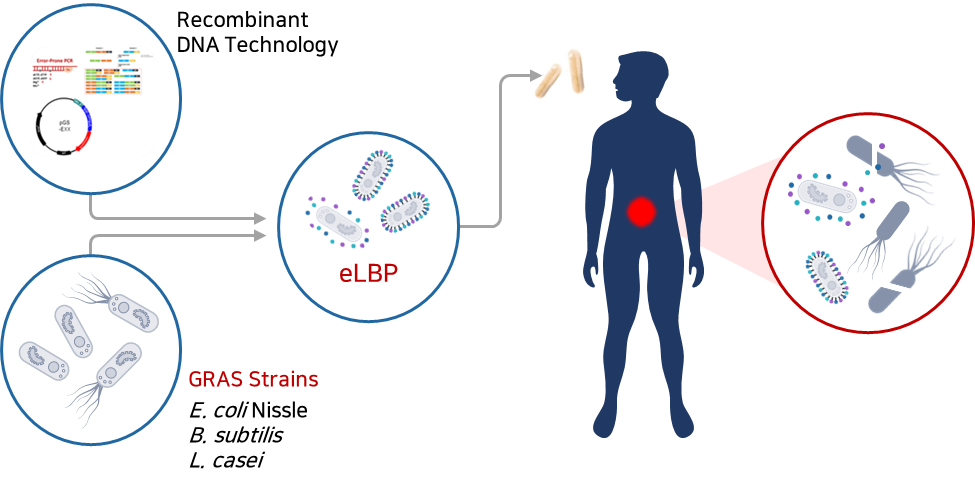
2020년 10월 설립한 ㈜리신바이오는 높은 수준의 분자생물학적 기술을 바탕으로 항생제 내성(AntiMicrobial Resistance, AMR) 감염병의 위협에 대응하기 위하여 재조합 엔도라이신 플랫폼과 eLBPs 플랫폼의 상호 유기적인 합성생물학 기반 연구 개발을 통해 슈퍼 박테리아 감염 치료제를 연구개발하고 있는 바이오 벤처기업입니다.
현재 동물 및 사람에게 치명적으로 작용하는 세균들을 타겟으로 GRAS(generally regarded as safe, 일반적으로 안전하다고 볼 수 있는 물질) strains DDS(Drug Delivery System, 약물이 체내에 전달되는 시스템) 기반 경구용 장내 세균성 감염 치료제 eLBPs와 Endolysin 기반 IV용 슈퍼 박테리아 감염 치료제 연구 개발을 진행하고 있습니다.
현재 인류는 1970년대 중반 이후 항생제 내성균 처치를 위한 신규 슈퍼 항생제 개발이 전무한 실정이며 2020년부터 겪어 온 코로나19 펜데믹을 통해 감염병의 위험성을 절감하고 있는 상황입니다. 세계보건기구(WHO)가 꼽은 ‘인류가 직면한 세계 10대 공중보건 위협’ 중 하나인 AMR은 세균이 균을 억제하거나 죽이기 위해 만들어진 약물 등에 노출됐음에도 죽지 않고 살아남는다고 해서 ‘제2의 암’이라고도 불립니다. 박테리아, 바이러스, 곰팡이나 기생충 등이 더는 약물에 반응하지 않아 감염 치료가 불가능해지고 심각할 경우 질병 확산, 사망자 급증 등의 문제로 확산할 위험이 있습니다. 2016년 영국 ‘Welcome Trust Foundation’의 보고서 「The review on antimicrobial resistance」는 2050년, 전 세계가 감염병으로 인해 암을 뛰어 넘는 1,000만 명의 사망자와 11경 원에 이르는 경제적 손실이 발생할 것이라고 경고한 바 있습니다.

이처럼 기존 화학 합성 항생제들이 갖는 작용기작과는 전혀 다른 작용기작의 새로운 항생제가 필요한 상황임에도 불구하고 1900년 이후 FDA로부터 승인된 항생제 총 164개 중 최근 35년간 신규 타겟으로 승인된 항생제는 단 1개(2012년 ATP 합성효소 저해제 Bedaquiline 결핵 감염에 대해 FDA 승인 획득)뿐이며, 계속해서 항생제 내성균 치료를 위한 개발이 전 세계적으로 진행되고 있는 상황입니다.
리신바이오는 기존 항생제의 Unmet Needs(미충족 욕구- 내성균 등장, 부작용 및 독성, 낮은 치료율, 재발률 등) 해결을 위한 글로벌 ‘차세대 항생제 개발 현황’에 주목하고 재조합 엔도라이신 플랫폼과 eLBPs 플랫폼의 상호 유기적인 합성생물학 기반 연구를 통해 슈퍼 박테리아 감염 치료제를 개발해오고 있습니다.
*플랫폼별 파이프라인

리신바이오는 합성 생물학 기반 단백질 신약 개발 기술(eLBPs)과 세계 최초 eLBP 기반 경구용 항생제 개발 기술(CMic) 등 확장성 높은 플랫폼 기술을 보유하고 있습니다.
❶ eLBPs (장내 세균성 감염 치료 경구용 단백질 신약)
장내 세균 C.difficile에 대한 기존 치료법인 메트로니다졸, 반코마이신 등 항생제 투약은 고독성(hypervirulent) 균주에 의한 난치성 중증 CDI(장내 질병 관여균) 치료 및 CDI의 재발 치료(재발 반복)는 어려워 2022년 12월, 세계 최초로 마이크로바이옴 치료제 레비요타(스위스 페링제약, 분변 이식 기술 기반)가 미국 FDA 승인을 받았습니다. 이후 국내외 마이크로바이옴 산업은 급성장하고 있으나 현재 CDI, 궤양성대장염 등의 마이크로바이옴 치료제는 프로바이오틱스 투여 및 대변 이식 등 숙주의 미생물을 조절하는 일부 기술이 적용되어 심각한 부작용 유발 가능성이 있습니다.
그러나 현재 리신바이오가 연구개발 중인 CDI(장내 질병 관여균) 치료제 ‘LB-CDL19’는 eLBPs (Engineered Live Biotherapeutics Products) 기반 정확한 작용기전을 갖는 경구용 치료제입니다. eLBPs는 반복적 투약 및 주사가 불필요한 차세대 마이크로바이옴 고도화 기술이 적용된 것으로 기존 치료제의 부작용은 물론 환자의 비용 절감 또한 현저하게 낮출 것으로 기대됩니다.
박테리오파지 유래 리신단백질을 이용한 치료제 개발을 진행 중인 국내·외 경쟁업체들의 경우 리신단백질을 재조합 균주로부터 발현시켜 분리·정제하고 이를 주사제 혹은 신체에 도포하는 외형제 형태의 의약품 개발에 집중하고 있는 상황입니다. 리신바이오 역시 동일한 기술로서 주사제, 외형제 형태의 단백질 기반 의약품 개발을 진행하고 있으며 이와 함께 장내에서 문제를 일으키는 다양한 병원균들의 치료를 위한 경구제 형태의 치료제 개발을 진행하고 있습니다.
그러나 여기서 주목할 점은 리신바이오의 가장 큰 차별성이라 할 수 있는, 타겟하는 세균에 대응하는 박테리오파지 유래 lytic 효소인 재조합 리신단백질을 장내에서 유익한 활동을 하는 프로바이오틱스(probiotics) 균주의 표면에 디스플레이 하거나 혹은 분비할 수 있게 제작하는 기술이며 최종 제작된 재조합 균주를 직접 경구로 투여할 수 있는 약물로 개발하고자 하는 것입니다. 이는 가축 및 인간의 장내 세균성 감염을 직접적으로 치료할 수 있는 living medicine으로서 국내는 물론 세계 최초로 개발을 진행하고 있습니다(‘개발 내용’ 참조).
현재 eLBPs기반 CDI(C. difficile 감염) Lead Compound를 선발하고 유전자 재조합 엔도라이신 Lead Compound 최적화 및 PILOT 생산 SOP(생산 표준운영절차)를 확립한 단계입니다.
❷ CMic Tech(eLBPs 기반 경구용 항생제)
리신바이오가 현재 CMic 기술을 활용하여 연구 개발 중인 치료제는 ‘LB-SAL09’와 ‘LB-ECL04’입니다.
‘LB-SAL09’는 화농성 염증, 중이염, 폐렴, 수술 후 창상 감염, 식중독 등을 일으키는 원인균인 S.aureus(황색포도상균)을 치료하는 기존 항생제의 내성균 MRSA, VRSA 감염증의 치료제입니다. MRSA는 메치실린계저항성 세균 황색포도상구균으로 개방된 상처가 있거나 면역체계가 약한 사람들의 감염 위험성이 높습니다. 또한 VRSA는 반코마이신저항성 세균 황색포도상구균으로 당뇨나 신장질환 등의 기저질환이 있을 때 위험이 높으며 중심정맥관 등을 보유하여 반코마이신 투여 중인 사람들에게 발생 위험이 매우 높습니다. 매년 수만명의 MRSA 균혈증 환자가 발생하고 약 3,000명 이상이 사망할 정도로 매우 위험합니다. 또한 S.aureus은 아토피피부 환자에게 높은 비율로 관찰되고 있는 균으로 알려져 있습니다. 치료제 실험 결과 S.aureus 전신감염 mouse model을 이용한 LB-SAL09의 유효성 확인하였고 도메인 셔플링 신규 엔도라이신 확보 실험에서도 Recombinant PCR을 통한 신규 Endolysin(LB-SAL00) 유전자를 확보하였습니다. 주사제로 개발하기 위한 세포 독성과 적혈구에 미치는 영향 실험에서도 모두 무해한 것으로 나타났습니다. 또한 환자로부터 분리한 항생제 내성 임상분리주에 대한 항균활성 실험 결과 표준균주와 내성균주에 모두 효과가 있었습니다.
‘LB-ECL04’는 그람 음성균 감염증 치료제입니다. 대표 다재 내성 병원균(MDR) 6가지 중 ‘다제 내성 아시네토바우마니 감염증’은 카바페넴계, 아미노글리코사이드계, 플로로퀴놀론계 항생제 내성균으로 제4급 법정감염병으로 분류되며, 전세계적으로 증가 추세에 있고 특히 국내 슈퍼박테리아 사망 원인 중 1위에 해당될 정도로 점차 그 심각성이 우려되고 있습니다.
‘그람 음성균’은 ‘그람 양성균’과 달리 내독소(Endotoxin)로 작용하는 세포 외막(outer membrane)이 존재하기 때문에 그람 음성균의 외막을 통과할 수 있고, 그람 음성균 사멸 시 방출하는 내독소를 중화할 수 있는 전략이 필요합니다.
리신바이오는 E. coli Bacteriophage 유래 endolysin 유전자 서열을 기반으로한 신규 재조합 endoysin 개발 연구를 진행하고 있습니다. 신규 엔도라이신 개발을 위한 실험 결과, 개발 물질은 유해균에는 효과를 보이지만, 장내 다른 유익균에는 영향을 미치지 않았으며 주사제로 개발하기 위한 세포 독성과 적혈구에 미치는 영향 실험에서도 모두 무해한 것으로 나타났습니다.
현재 유전자 재조합 엔도라이신 Lead Compound 최적화 및 PILOT 생산 SOP(생산 표준운영절차)를 확립한 단계입니다(‘개발 내용’ 참조).
리신바이오는 원천 기술에 대한 특허 보호, 파이프라인별 지식재산권 확보로 높은 진입장벽을 구축하고 있습니다(현재까지 특허등록 3건, 도입 특허 1건, PCT 출원 1건, 특허출원 2건).
이와 함께 연구개발 능력을 인정받아 중소벤처기업부 주관의 국책과제 3개에(TIPS, BIG3, TIPS 창업화사업)에 선정되어 각각 5억원, 5.7억원, 0.7억원을 지원받고 연구과제를 진행하고 있으며(과제 종료 1건), 2023년 6월에는 중소벤처기업진흥공단(중진공)으로부터 '성장공유형 자금' 투자 유치에 성공하였습니다. '성장공유형 자금'은 우수한 기술력과 사업성을 보유한 유망 중소벤처 기업 중 기업공개(IPO) 가능성이 높은 기업을 대상으로 투자를 진행하는 사업입니다. 현재 파이프라인별 효능 및 안정성을 확인한 리드물질을 확보한 단계로서 이번 중진공 성장공유형 자금 투자 유치를 통해 내년 2건 이상의 전임상 시험을 차질없이 준비할 계획입니다. 또한 국내 기술신용평가기관(TCB)인 NICE평가정보(주)의 기술 평가 심사에서 ‘합성생물학 기반 경구용단백질 신약 개발 기술’에 대하여 T-5 우수 등급을 받아 '2023년 기술평가 우수기업'으로 인증 받았습니다(‘사업 성과’ 참조).
리신바이오의 수익창출 전략은, 스타트업으로서 기초연구부터 의약품 승인까지 모든 과정을 진행하는 전통적인 제약 기업과 달리 비임상 단계부터 국내 제약사 또는 글로벌 빅파마로의 기술이전을 통한 수익을 창출하는 것입니다. 이 중 eLBPs 치료제의 기술 이전은 eLBPs의 인허가가 상대적으로 용이한 해외기업을 대상으로 접촉할 계획입니다.
2018년, 인트론바이오-스위스 로이반트 간 SAL200(엔도라이신) 기술이전 계약 시 최대 마일스톤은 1조원, 계약금(Upfront)은 1,000만 달러였습니다. 또한 최근의 사례로, 신약 개발 바이오 기업인 디앤디파마텍이 비만 치료제와 비알코올성지방간염(NASH) 치료제 등 신약 파이프라인의 경쟁력을 앞세워 시가총액 4,380억으로 코스닥에 기술특례상장하는 성과를 거두었습니다. 디앤디파마텍의 주요 파이프라인 중의 하나인 비만치료제는 임상시험계획(IND) 준비와 후보물질 도출 단계에서 미국의 멧세라에 기술 이전, 비알코올성지방간염 치료제는 미국에서의 임상 1상을 완료하고 중국 선전살루브리스제약으로 기술이전하였습니다.
리신바이오는 eLBPs와 CMic 파이프라인의 단계별 성과를 바탕으로 2027년 기술 이전 성과에 따른 IPO 추진을 위해 IBK투자증권(주)과 코스닥 상장 대표주관계약을 체결하였습니다(2023년 5월). 이번 계약을 통해 IBK투자증권(주)은 대표주관회사로서 리신바이오의 코스닥 시장 상장 준비를 위해 경영 관리, 재무 회계 및 세무 관리, 코스닥시장 상장규정에 의한 상장 요건 충족 여부 등에 대한 점검 및 자문 업무를 수행해 나갈 계획입니다.
또한 기술 이전까지의 사업구조가 약한 R&D 회사의 어려움을 극복하기 위해 정부 연구과제 수행 외에 인체용 신규 항생제 개발과 더불어 빠른 시장 진입이 가능한 가축대상 항생제 대체제, 보조사료(미생물제), 유기태 및 당사 플랫폼 기반 기능성 화장품 등의 개발 및 사업화를 진행 중이며 이를 통해 기술 이전 성과에 따른 IPO 추진 전까지 안정적인 캐시카우를 확보해 나갈 계획입니다.
리신바이오는 차세대 표적 항생제를 개발하여 기존 항생제 Unmet Needs 시장에서 플랫폼 기반 First-in-class 신약 개발 전문기업으로 성장해 나갈 것입니다.
비전 및 목표
비전
플랫폼 기반 First-in-class 신약개발 전문기업

| Creative Plaform | Unmet Needs | |
|
• 합성 생물학 기반 단백질 신약 개발 기술 • 세계 최초 eLBP 기반 경구용 항생제 개발 기술 • 확장성 높은 플랫폼 기술 보유 |
→ |
• 합성 생물학 기반 재조합 단백질 생산기술 - 다재내성균 / 그람 음성균 처치용 항생제 시장 공략 • eLBP 플랫폼 기술 - 전문약이 없는 난치성 병원균 치료제 시장 공략 |
목표
차세대 표적 항생제 개발로
기존 항생제 Unmet Needs(미충족 수요) 시장 GLOBAL 1위 기업
| 기존 항생제 | 차세대 표적 항생제 | |
|
• 목표하는 병원성 세균 뿐만 아니라 유익균까지 공격 • 유익균 공격에 따른 부작용 및 독성 발생 • 내성균 발생 심각 |
→ |
• 기존 항생제와는 다른 새로운 MOA • 선택적 타켓(병원균) 공격 가능 • 내성균에도 효과적인 살균 작용 • eLBP 기반 경구용 항생제 개발 가능 |
↑
기존 항생제 Unmet Needs 문제 해결
*Unmet Needs : 내성균 등장, 부작용 및 독성, 낮은 치료율, 높은 재발률 등
*Unmet Needs : 내성균 등장, 부작용 및 독성, 낮은 치료율, 높은 재발률 등
조직 소개
조직도
경영진



연구인력
| 성명 | 직위 | 학력 | 주요경력 | 담당업무 |
|---|---|---|---|---|
| 서민호 | 팀장 | 한국외대 생명공학(학사) 한국외대 생명공학(석사) |
• 크린시스템스 코리아(주) 사원 (‘08~’11) • (주)LSM 개발팀장(‘12~‘20) |
정제공정/발효공정 |
| 채숙희 | 연구원 | 서울대 농생물학(학사) 서울대 농생물학(석사) |
• (주)대웅제약(‘95~’97) | 동물세포배양/in vitro 유효성 검증 |
| 안태규 | 연구원 | 강원대 생명공학(학사) 강원대 생명공학(석사) |
• (주)중겸 연구원(‘20~’21) • 아이진(주) 연구원(‘21~’22) |
DNA &protein work |
| 박선일 | 연구원 | 안동대 생물학(학사) 안동대 생물학(석사) |
- | 박테리오파지 스크리닝 |
| 전다혜 | 연구원 | 충남대 미생물분자생명과학 (학사) | - | DNA & protein work |
사업 영역
의학 및 약학 연구 개발
| GRAS 미생물 기반 단백질 신약 eLBPs 연구 개발 |
+ | 슈퍼 항생제 연구 개발 |
↓
※ 현재 동물 및 사람에게 치명적으로 작용하는 세균들을 타겟으로 ❶ GRAS(generally regarded as safe) strains DDS 기반 경구용 장내 세균성 감염 치료제 eLBPs와 ❷ Endolysin 기반 IV용 슈퍼 박테리아 감염 치료제 개발을 위한 연구를 진행하고 있음
사업 배경
| Unmet Needs 충족 가능한 차세대 항생제 개발 필요성 증대 |
항생제 내성균 문제의 심각성에 주목

① 항생제 내성균 문제의 심각성
- 2050년에는 암 사망자 수를 뛰어넘는 연간 1천만 명의 감염병 사망자 발생 예상
- 이에 따른 경제적 손실이 약 11경원에 이를 것으로 예상됨
항생제 개발이 항생제 내성균 문제로 한계에 봉착
|
|
|
• MRSA : 메치실린계 항생제 저항성 세균 • VRE : 반코마이신 항생제 저항성 세균 |
• PDR : 모든 항생제 종f종에 저항성 세균, AMR 항생제 내성 |
|
• MRSA : 메치실린계 항생제 저항성 세균 • VRE : 반코마이신 항생제 저항성 세균 • PDR : 모든 항생제 종f종에 저항성 세균, AMR 항생제 내성 |
WHO, 신규 항생제 개발이 시급한 세균 12종 발표 (2017년)
|
|

* 2050년, 인류 사망 원인 분포

* 대륙별 감염병 사망자수

* 출처 : ‘The review on antimicrobial resistance’, Jim O’Neill, 2016
② 새로운 작용기작을 갖는 항생제 개발 필요
- 기존 화학 합성 항생제들의 경우 새로운 제품 출시 이후 내성균 출현시기가 점점 빨라지고 있음
- 기존 화학 합성 항생제들이 갖는 작용기작과는 전혀 다른 작용기작의 새로운 항생제가 필요한 실정임

Unmet Needs 충족 가능한 차세대 항생제 개발 현황에 주목
① 항생제 개발 현황
- 미국 질병통제예방센터(CDC)와 세계보건기구(WHO) 등은 기존 항생제의 효과 감소로 인류 생명이 위협받을 것으로 예측
- 1900년 이후 FDA으로부터 승인된 항생제 총 164개이며, 이 중 최근 35년간 신규 타겟으로 승인된 항생제는 단 1개뿐임.
- 2012년 ATP 합성효소 저해제 Bedaquiline 결핵 감염에 대한 FDA 승인 획득
<1900∼2019년 FDA 항생제 승인 현황>
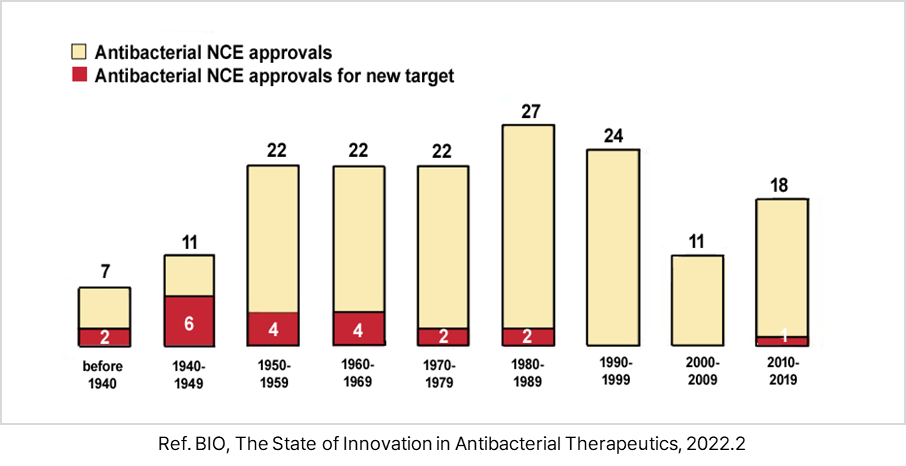
② 기존 항생제 내성균 치료를 위한 항생제 개발 현황
- 전 세계적으로 항생제 내성균에 의한 사망자가 발생(EU 25,000명, USA 23,000명)하고 있으며 항생제 내성균 치료를 위한 개발은 많은 국가에서 진행되고 있음
<약제 내성균 치료 항생제 개발 현황>

③ 마이크로바이옴 치료제 경쟁사 R&D 현황

④ 전 세계 eLBPs 임상 현황
※ 리신바이오와 유사한 플랫폼 기술로 미국에서 진행되고 있는 현황

* 출처: Development of synthetic biotics as treatment for human diseases, 2021
⑤ 국내 제약 바이오기업의 비임상 단계 기술 이전 현황(2022년)
- 2022년 제약바이오 기업(비임상∼1상) 라이센스 아웃 최대 마일스톤 현황
- 2022년 제약바이오 기업(비임상∼1상) 라이센스 아웃 계약금 현황(공개 8건)

* 출처: ‘바이오(신약개발 관련) Deal 정리’, 국가신약개발사업단, 2023

* 출처: ‘바이오(신약개발 관련) Deal 정리’, 국가신약개발사업단, 2023
⑥ 국가별 유전자 재조합 생균 의약품 인허가 동향
미국 FDA
* 출처: ‘국내외 마이크로바이옴 바이오의약품의 규제동향’,배진우, 2020 |
유럽 EMA
* 출처: ‘국내외 마이크로바이옴 바이오의약품의 규제동향’,배진우, 2020 |
국내 식약처
* 출처: ‘생균치료제의 임상시험시 품질 가이드라인(민원인 안내서)’, 식품의약품안전평가원, 2022 |
⇣
|
비임상 준비 단계부터 식약처와 사전 조율 |
기술 경쟁력
|
① eLBPs(Engineered Live Biotherapeutics Products) 기술 |
- E. coli Nissle1917, B. subtilis 등을 생균치료제로 형질 전환하여 단백질 신약 물질을 세포 표면에 디스플레이하거나 세포 외 분비하도록 제작하여 부작용 해결 및 치료 효과 개선
- 세포 표면 발현 시스템 개발 Know-how 확보
- 세포 외 분비 발현 시스템 개발 Know-how 확보 - ‘살아있는 의약품’이라고 불리며
- 의약품 분비 미생물 착상 시 반복적 투약 및 주사가 불필요하고
- 합성생물학의 의학 혁신 사례에 속하는 기술임
(출처: ‘합성생물학의 미래’, 과학기술정보통신부, 2023년) - 2022년 12월, 세계 최초로 마이크로바이옴 치료제 레비요타(스위스 페링제약, 분변 이식 기술 기반)가 미국 FDA 승인을 받은 이후 국내외 마이크로바이옴 산업은 급성장하고 있으나 현재 CDI, 궤양성대장염 등의 마이크로바이옴 치료제는 프로바이오틱스투여 및 대변 이식 등 숙주의 미생물을 조절하는 일부 기술이 적용되어 심각한 부작용 유발 가능성이 있음
(출처: ‘마이크로바이옴 R&D 및 산업화를 위한 전략’, 국가생명공학정책연구센터, 2022)
|
*유전자 조작 생균의약품(eLBPs) |
※ 리신바이오 기술 vs 기존 기술
| 구분 | 기존 기술 | 리신바이오 기술 |
|---|---|---|
| 제조방법 | 기증자 분변이식 유래 균주 | 유전자 조작 균주 |
| 장점 | • 임상 3상 제품 출시 • 균주분리 및 대량 배양 용이 |
• 부작용 가능성 낮음 - 특정 유해균만을 표적 • 반복 투약 및 주사 불필요 - 장 생착후 치료제 생산 |
| 단점 | • 부작용 가능성 - 복통, 복부 팽만감 등 • 환자 간 치료 효능 차 존재 - 품질 균일성 보장 어려움 • 부작용 가능성 - 복통, 복부 팽만감 등 |
• 비임상 전 단계부터 식약처와 사전 조율 필요 |
| 제조기업 | • 페링제약(스위스) • 세레스테라퓨틱스(미국) • 핀치테라퓨틱스(미국) |
㈜리신바이오 |
|
② CMic-LB(엔도라이신) 기술 |
- 기존 항생제의 많은 문제점을 해결할 수 있는 엔도라이신 단백질을 이용한 치료제를 개발 중이며
- 엔도라이신을 재조합 균주로부터 발현시켜 분리·정제하고 이를 주사제 혹은 신체에 도포하는 외형제 형태의 의약품 개발에 집중하고 있음
※ 엔도라이신 단백질 vs 기존 항생제


개발 내용
개발 방향
|
엔도라이신의 한계를 극복하고 장(腸)내 병원성 세균 처치를 위한 합성생물학 기반의 경구용 eLBPs (Engineered Live Biotherapeutic Products) 생균치료제 및 주사제(IV) 개발 |
※ eLBPs(Engineered Live Biotherapeutic Products): 유전자를 의도적으로 삽입하거나 결실, 변형을 통해 조작된 미생물로 구성된 생물학적 치료제
|
|
핵심기술
1. eLBPs 기술_작용기전
① eLBPs이란
|
장내 세균성 감염 치료 경구용 단백질 신약으로 장내에서 유익한 활동을 하는 프로바이오틱스(probiotics) 균주인 E. coli Nissle 1917, B. subtilis 등에 목적 유전자를 도입하여 엔도라이신 등 단백질 신약 물질을 세포 표면에 디스플레이(display) 하거나 혹은 세포 외 분비(secretion) 할 수 있게 제작하는 기술 적용 → 반복적 투약 및 주사가 불필요한 차세대 마이크로바이옴 고도화 기술로서 환자의 비용 절감은 물론 기존 치료제의 부작용 또한 현저하게 낮출 수 있음 |

|
엔도라이신의 불안정성을 해결하고 장내 세균성 감염을 치료하는 경구용 치료제 |
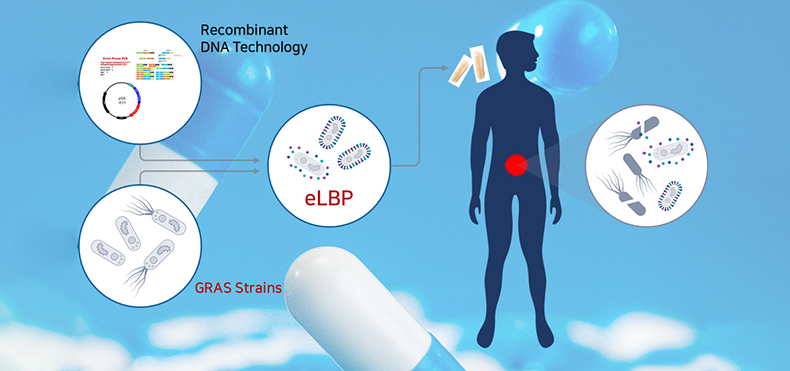
② 기술 확보
- 세포 표면 발현 시스템에 대한 개발 노하우 확보
- 목적하는 단백질을 미생물 세포 표면에 발현시키는 기술 보유

- 세포 외 분비 발현 시스템 개발 노하우 확보
- 발명 명칭: ‘엔도라이신을 생산하는 형질전환 바실러스 서브틸리스 균주’

③ eLBPs R&D 현황
a. GRAS strain E. coli Nissle 1917을 활용한 세포 표면 발현기술 확립
- 세포표면 발현 설계도
- 세포표면에 발현된 엔도라이신의 항균 활성(좌측: 샘플 주위에 clean zone 형성)
- 세포표면 발현 확인(엔도라이신에 형광물질 도포 - 우측 노란색)
- SDS-PAGE를 통한 엔도라이신 발현 여부 확인




b. GRAS strain B. subtilis 를 활용한 세포 외 분비 발현 기술 확립
- 현재 B. subtilis, E. coli Nissle1917 등에서 세포 외 분비 효율이 높은 signal peptide library 구축 완료


2. CMic-LB Technology (맞춤형 엔도라이신 선별 기술)
- 특정 도메인(Domain)간의 융합을 통한 고활성 엔도라이신 확보
- AMP(항균활성 펩타이드) 융합을 통한 그람 음성균외막(OM) 효율적 투과
- 타겟 세균 선택적 공격
- 기존 항생제와는 다른 작용기작으로 내성균에 대한 효과적 사멸 효과
- 타겟세균 특이적 엔도라이신 유전자 교체만으로 새로운 파이프라인 확보 가능


개발 파이프라인
- eLBPs 기술: eLBPs기반 CDI(C. difficile Infection) Lead Compound 선발
- CMic 기술: 유전자 재조합 엔도라이신 Lead Compound 최적화, PILOT 생산 SOP 확립

※ 용어 정의
- 적응증: 어떠한 약제나 수술 등에 의해 치료 효과가 기대되는 병이나 증상
- CMC(Chemical, Manufacturing and Control): 의약품을 만드는 공정 개발과 품질 관리 확립 단계
- Lead Compound: 선도물질
- 생산 SOP: 생산 표준운영절차
- CDI: 클로스트리듐 디피실균 감염증(장내 질병 관여균)
개발 제품군
1. CDI (장내 질병 관여균) 치료제 (LB-CDL19)
① 기존 항생제 부작용 및 리신바이오의 솔루션
〔기존 항생제 부작용〕
- 기존 치료법인 메트로니다졸, 반코마이신 등 항생제 투약은 고독성(hypervirulent) 균주에 의한 난치성 중증 CDI 치료 및 재발을 반복하는 CDI의 재발 치료는 부적절하기 때문에 효과적 치료법 개발 필요

〔기증자 분변 유래 마이크로바이옴 신약〕
* 출처: Global Industry Analysts, 2021 |
MOA(작용기전) 없음 |
* 출처: Global Industry Analysts, 2021 |
|
MOA(작용기전) 없음 |
⇣
※ 프로바이오틱스 투여 및 대변 이식 등 숙주의 미생물을 조절하는 일부 기술은 숙주에 심각한 부작용 유발 가능성이 있음
〔리신바이오의 솔루션〕
- 합성생물학을 기반으로 한 마이크로바이옴의 치료 분야 응용성 확장하여
→ eLBPs 기반 정확한 작용기전을 갖는 경구용 CDI 치료제 개발 목표
② 개발 현황 및 특징
C. difficile만을 타겟하는 맞춤형 endolysin 확보
실험결과 1
|
|
||||
|
|
실험결과 2
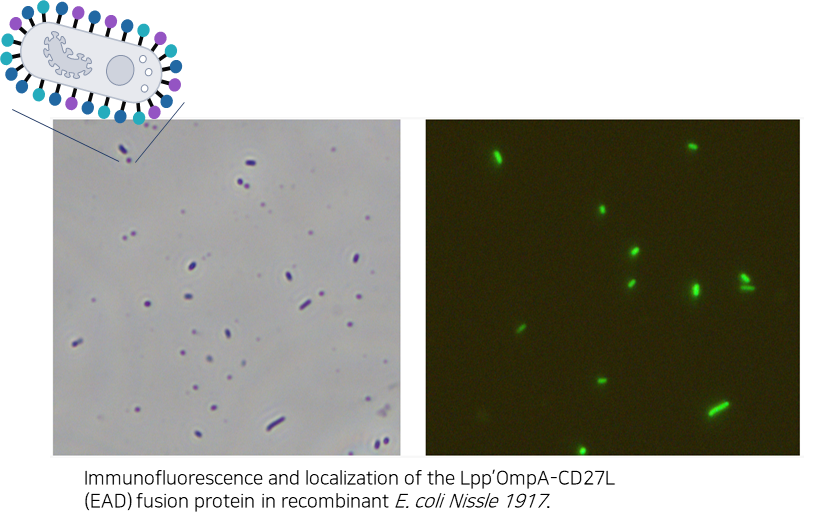
- C. difficile을 타겟하는 엔도라이신(LB-CDL19)의 E. coli Nissle1917 세포표면 발현 확인 및 Galleria mellonella infection model을 통한 유효성 확인
세포 표면 발현이 잘되었는지를 확인하기 위해 해당 엔도라이신에 형광물질을 입혀 현미경으로 찍은 사진 → 세포 표면 발현 확인
Galleria mellonella Infection Model을 이용한 LB-CDL19의 유효성 확인

* 좌측 : 세균 감염후 당사 개발 물질 미처리로 부채명나방 유충 사망
* 우측 : 세균 감염후 당사 개발 물질 경구 투입 후 부채명나방 유충 생존
3D 단백질 구조 및 활성 사이트에 대한 조사
- 리드물질 LB-CDL9에서 H10, E27, H85 세 개의 활성사이트가 모두 존재해야만 항균 황성이 있음을 확인

B. subtiils 에 유전자 조합된 엔도라이신이 분비되는 것에 대한 실험 결과
|
|
↓
|
|
경구용이므로 위장관과 장관에서 유전자 재조합된 엔도라이신분비하는 생균치료제의 생존에 대한 실험 결과
- 재조합된 생균치료제인 B. subtilis(eLBP) 장에서 100% 생존을 확인함
<인공 위액&장액에서 재조합 B. subtilis(eLBP)의 생존율 실험>

<인공 위액&장액에서 재조합 B. subtilis(eLBP)의 생존율>

* 인공위액과 장액은 염산용액을 첨가하여 pH 2.0 혹은 pH 7.0으로 조정
C. difficile CCARM0161 전신 감염 마우스와 부채명나방을 이용한 LB-CDL19의 보호 분석
<In vivo 실험 계획(마우스와 부채명나방 대상)>
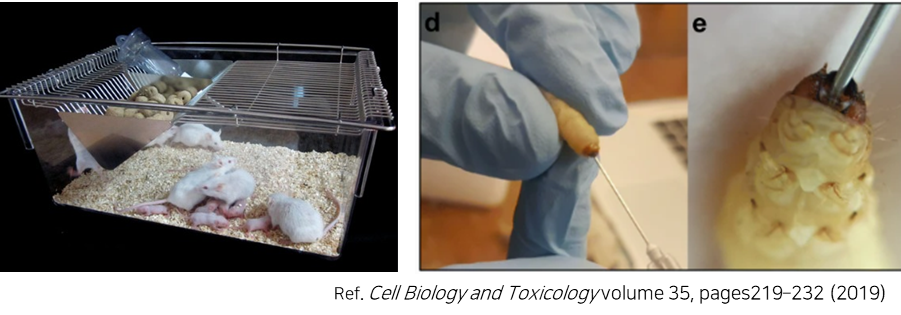
③ CDI 치료제 R&D 세부 일정 (C. difficile)



2. MRSA, VRSA 감염증 치료제 (LB-SAL09)
① 개발의 필요성
- S. aureus (포도상구균)을 치료하는 기존 항생제에 대한 내성 발생
- 특히 변종으로 인한 기존 항생제에 대한 내성 발생 (예: MRSA, VRSA)
- 메치실린계저항성 세균 황색포도상구균
- 개방된 상처가 있을 때, 외과적 장비를 사용하고 있거나 면역체계가 약한 사람들의 감염 위험성이 높음
- 반코마이신저항성 세균 황색포도상구균
- 내성기전으로 D-Ala-D-Ala 잔기의 변형체인 D-Ala-D-Lac, D-Ala-D-Ser을 만들어 반코마이신 작용을 감소시킴
- 당뇨나 신장질환 등의 기저질환이 있을 때 위험이 높으며 중심정맥관 등을 보유하고 있을 때 반코마이신 투여 중인 사람들에게 발생 위험이 높음
- 항생제 내성균 신고 건수 매년 8만건 이상, 이 중 1위는 MRSA
- 매년 수 만명의 MRSA 균혈증 환자 발생하고 약 3,000명 이상 사망
- 경제적 손실은 1,128억 원 - 아토피 피부염 환자들에게 S. aureus (포도상구균)이 중요 원인균
- S. aureus 는 아토피 환자 피부환자에게서 높은 비율로 관찰됨- 초항원으로 작용함에 따라 T세포 자극 → 사이토카인↑→ 피부 염증, 면역반응
- 아토피 피부염 환자의 경우 정상인에 비해 포도상구균 분포가 높음(피부지질 조성 변화→ 피부장벽 기능↓→ 피부염 증상 악화 → 중증도→ 가려움, 진물, 수면 장애→ 삶의 질 악화)

* S. aureus (포도상구균)
화농성 염증, 중이염, 폐렴, 수술 후 창상 감염, 균혈증, 심내막염, 식중독 등을 일으키는 원인균
| MRSA (Methicillin Resistant S. aureus) |
|
| VRSA (Vancomycin Resistant S. aureus) |
|
* MRSA, VRSA은 법정감염병으로 의료관련 감염병 ‘다제내성균 6종’ 내 포함

<아토피 피부염 발생 과정>

② 치료제 실험 결과
- S. aureus 전신감염 mouse model을 이용한 LB-SAL09의 유효성 확인
- 메치실린계 및 반코마이신 저항성 황색포도상구균을 타겟으로 하는 재조합 엔도라이신 연구 설계
- 도메인 셔플링(재조합)을 통해 신규 엔도라이신 확보 실험 결과
- 확보된 신규 엔도라이신의 종류별·시간대별 항균 활성도 연구 결과
- 선정된 신규엔도라이신 SAL-09의 농도별 항균활성도 연구 결과
- 선정된 SAL-09의 바이오필름에 대한 효과 검증 실험
- 주사제로 개발하기 위한 세포 독성(좌측)과 적혈구에 미치는 영향(우측) 실험 결과
- 세포 독성 및 용혈현상이 나타나지 않는 결과 - 온도별·시간대별 세균 생존율 실험 결과
- 환자로부터 분리한 항생제 내성 임상분리주에 대한 항균활성 실험 결과
- 표준균주와 내성균주에 모두 효과 있음 (좌측)
- 내성균주에 대한 효과 용량 실험 결과 (우측)

|
<야생에서 분리한 박테리오파지 추출 엔도라이신 도메인 구조>
|
|
|
|
<선정된 도메인의 Shuffling 설계 계획도>
|
|
Design of Recombinant endolysins
|
Recombinant PCR을 통한 신규 Endolysin(LB-SAL00) 유전자 확보
|
|
Design of Recombinant endolysins
|
|
Recombinant PCR을 통한 신규 Endolysin(LB-SAL00) 유전자 확보
|
|
<1차 항균활성실험> (SAL03,SAL05,SAL09 선정)
The lytic activity of LB-SAL01~10 shown on a lawn of S. aureus. |
<2차 시간대별 항균활성 실험> (최종 SAL09 선정)
항균활성능 비교
LB-SAL03VSLB-SAL05VSLB-SAL09
|
|
<1차 항균활성실험> (SAL03,SAL05,SAL09 선정)
The lytic activity of LB-SAL01~10 shown on a lawn of S. aureus. |
|
<2차 시간대별 항균활성 실험> (최종 SAL09 선정)
항균활성능 비교
LB-SAL03VSLB-SAL05VSLB-SAL09
|
|
황색포도상구균에 대한 LB-SAL09
* 고농도일수록 빠른 항균 활성 보임 |
빠른 항균 속도를 보여주는 동영상
왼쪽: liquid media |
|
황색포도상구균에 대한 LB-SAL09
* 고농도일수록 빠른 항균 활성 보임 |
|
빠른 항균 속도를 보여주는 동영상
왼쪽: liquid media |
|
내성이 생장하여 바이오필름이 형성된 것에 대한 비교 실험
*1시간 후 기존 항생제인 반코마이신에서는 항균활성이 보이지 않았으나 당사 리드물질 SAL09에서는 Clean Zone이 형성되어 항균활성이 있음이 나타남 |
내성균이 빠르게 사멸하는 것을 보여주는 동영상
Time-lapse microscopy. |
|
내성이 생장하여 바이오필름이 형성된 것에 대한 비교 실험
*1시간 후 기존 항생제인 반코마이신에서는 항균활성이 보이지 않았으나 당사 리드물질 SAL09에서는 Clean Zone이 형성되어 항균활성이 있음이 나타남 |
|
내성균이 빠르게 사멸하는 것을 보여주는 동영상
Time-lapse microscopy. |
|
세포 독성
Cytotoxicity assay of LB-SAL09 in a Huh7 cell line. Cells were incubated with different concentrations of LB-SAL09 for 24hr |
적혈구에 미치는 영향
Hemolytic activity of LB-SAL09. RBCs were incubated with PBS or LB-SAL09 at 37℃ for 1 h, and hemolysis was determined by measuring the absorbance of the supernatant at 570 nm. 0.1% of Triton X-100 was used as the hemolysis control agent. |
|
세포 독성
Cytotoxicity assay of LB-SAL09 in a Huh7 cell line. Cells were incubated with different concentrations of LB-SAL09 for 24hr |
|
적혈구에 미치는 영향
Hemolytic activity of LB-SAL09. RBCs were incubated with PBS or LB-SAL09 at 37℃ for 1 h, and hemolysis was determined by measuring the absorbance of the supernatant at 570 nm. 0.1% of Triton X-100 was used as the hemolysis control agent. |
|
“Decrease in bacterial viability after the addition of LB-SAL09 (1.0 µM) at different temperature” *Negative control : 개발물질 미처리로 세균 생존 리드 발물질 처리시 20~40도에서는 세균이 사멸하나 50도 이상에는 개발물질의 변형으로 세균 생존
→ 사람의 체온은 약 36.5도이므로 주사제 개발에 문제 없음 |
Decrease in bacterial viability after the addition of LB-SAL09 (1.0 µM) at different time lengths |
|
“Decrease in bacterial viability after the addition of LB-SAL09 (1.0 µM) at different temperature” *Negative control : 개발물질 미처리로 세균 생존 리드 발물질 처리시 20~40도에서는 세균이 사멸하나 50도 이상에는 개발물질의 변형으로 세균 생존
→ 사람의 체온은 약 36.5도이므로 주사제 개발에 문제 없음 |
|
Decrease in bacterial viability after the addition of LB-SAL09 (1.0 µM) at different time lengths |
|
MRSA 임상분리주를 대상으로한
|
다양한 황색포도균주에 대응하는 LB-SAL09의 최소억제농도 및 최소살균농도
|
|
MRSA 임상분리주를 대상으로한
|
|
다양한 황색포도균주에 대응하는 LB-SAL09의 최소억제농도 및 최소살균농도
|
③ MRSA, VRSA 치료제 R&D 세부 일정


| Product Name | LB-SAL09 |
| Product Source | E.coli expression system |
| Biological Activity |
|
| MIC | < 10 ug/ml |
| Purity | Peak % area > 98.0% by SEC-HPLC |
| Endotoxin | Endotoxinlevel is < 1EU/mg |
| IP | 특허 등록 2건 이상 |
3. 그람 음성균 감염증 치료제 (LB-ECL04)
① 그람 음성균의 위험성 (개발의 필요성)
- 그람 양성균과 달리 내독소(Endotoxin)로 작용하는 세포 외막(outer membrane) 존재
- Gram(-) pathogens (그람음성균)의 다재내성 감염증
- 카바페넴계, 아미노글리코사이드계, 플로로퀴놀론계항생제 내성
- 전 세계적으로 증가 추세
* 2017년 MRAB 감염 8,500건 발생, 700명이 사망 (2019, AR Threats Report, CDC) - 국내현황
- 국내 슈퍼박테리아 사망원인 중 1위 - 기존 항생제에 대한 내성이 나타남에 따라 기존 항생제 개발 방법은 한계가 있으며 새로운 전략 필요
<그람 음성균의 세포벽 모식도>


<그람 음성균의 세포벽 모식도>

↑
※ 다제 내성 아시네토바우마니 감염증 (* 제4급 법정감염병)
(MRAB: Multidrug-resistant Acinetobacter baumanniiinfection)
※ 대표 다재내성병원균(MDR)
- ESKAPE
Enterococcus faecium
Staphylococcus aureus
Klebsiellapneumonia
Acinetobactorbaumannii
Pseudomonas aeruginosa
Enterobacter
*중환자실에서 분리되는 A. baumannii
카바페넴항생제 내성률



② 치료제 실험 결과
- E. coli Bacteriophage 유래 endolysin 유전자 서열을 기반으로한 신규 재조합 endoysin 개발 진행
- 항균펩타이드 재조합 모식도 및 유전자 발현 확인
- 신규 엔도라이신 개발을 위한 기초 실험 결과
- ECL-01, ECL-02에서 항균 활성 보임 - 리신바이오 개발 물질의 유해균과 유익균 적용 결과
- 리신바이오의 개발 물질은 3종의 유해균에 효과를 보임
- 장내 다른 세균(유익균 포함)에는 영향을 미지치 않음
- 목적하는 유해세균(E. coli strains, A. baumannii, P. aerugonosa)에만 항균 활성이 있고, 유익균 및 다른 세균에는 영향을 미치지 않는 결과 데이터 확인
- 주사제로 개발하기 위한 세포 독성(좌측)과 적혈구에 미치는 영향(우측) 실험
- 모두 무해한 것으로 나타남 - 내성균에 대한 농도별 항균 활성도 체크
- 좌측 : 고농도에서 높은 활성도 보임
- 우측: 시간대별 세균수 체크 (1분 후 세균 전부 사멸) - 내성균주(E. coli, A. baumanni)에 대한 효과 용량 실험 결과 데이터
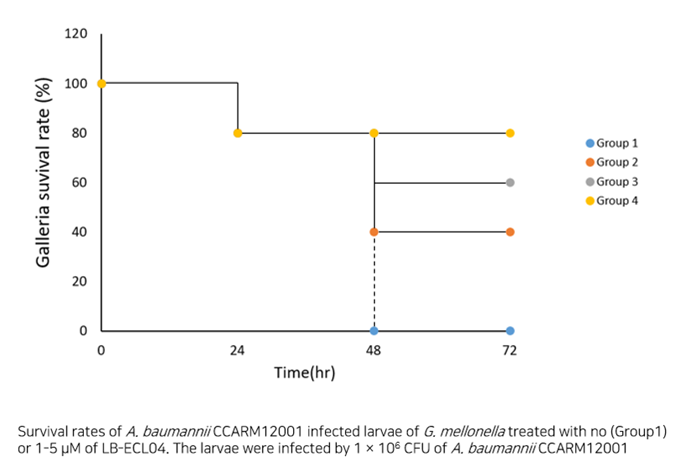
- Galleria mellonella infection model을 통한 LB-ECL04의 유효성 확인
- 좌측 : 세균 감염 후 당사 개발 물질 미처리로 부채명나방 유충 사망
- 우측 : 세균 감염 후 당사 개발 물질 경구 투입 후 부채명나방 유충 생존
(* Bacteriophage: 세포 분해 바이러스→ 세균을 숙주로 하는 바이러스로 세균바이러스로 불림)

* 그람양성균과 그람음성균의 세포벽 차이




*재조합 엔도리신 LB-ECL00, ECL01 및 ECL02 발현
(유도조건: IPTG 0.1mM, 20℃. 18시간)

ECL00, ECL01, ECL02는 각각 10ul(200ng/ul) 점적 37°C 20hr incubation

Antibacterial activities of endolysins. Antibacterial activity of endolysins (2 µM) against E. coli DH5a and E. coli O157:H7 in PBS buffer (pH 7.4) for 1 h. PBS buffer was used as a negative control.
(엔도리신의 항균 활성. 엔도리신(µ M)의 대장균에 대한 항균 활성 대장균 DH5a 및 대장균 O157:PBS 완충액(pH 7.4)에서 1시간 동안 H7. PBS 완충액을 음성 대조군으로 사용)
Lead compound LB-ECL04 확보




Antibacterial activities of endolysin LB-ECL04. Antibacterial activity of LB-ECL04(1~4µM) against E. coli strains, A. baumannii, P. aerugonosa, K. pnemoniae, S. typhimurium, S. aureus, L. lactics, L. casei, L. acidophilus and L. plantarum in 20 mM PBS buffer (pH 7.5) for 1h. PBSbuffer was used as a negative control(0uM). Dotted line denotes the detection limit.
(엔도리신 LB-ECL04의 항균 활성 실험 : E. coli strains , A. baumannii, P. aerugonosa, K. pnemoniae, S. typhimurium, S. aureus, L. lactics, L. casei, L. acidophilus and L. plantarum 등 유해세균의 대장균 균주에 대한 LB-ECL04 (1~4 µM)의 항균 활성 실험을 위해 20 mM PBS 완충액(pH 7.5)에 1시간 동안 PBS 완충액을 음성 대조군(0uM)으로 사용/점선은 검출 한계를 나타냄)

Cytotoxicity assay of LB-ECL04 in a Huh7 cell line. Cells were incubated with different concentrations of LB-ECL04 for 24hr
(Huh7 세포주에서 LB-ECL04의 세포독성 분석, 세포를 상이한 농도의 LB-ECL04와 함께 24시간 동안 배양)

Hemolytic activity of LB-ECL04. RBCs were incubated with PBS or LB-ECL04 at 37℃ for 1 h, and hemolysis was determined by measuring the absorbance of the supernatant at 570 nm. 0.1% of Triton X-100 was used as the hemolysis control agent.
(LB-ECL04의 용혈능력에서, RBCs는 37℃에서 1시간 동안 PBS 또는 LB-ECL04와 함께 배양, 용혈은 570 nm에서 상등액의 흡광도를 측정, 용혈조절제로 Triton X-100을 0.1% 사용)

Antibacterial activities of different concentrations of LB-ECL04(0.03, 0.06, 0.125, 0.25, 0.5or 1µM) against A. baumannii CCARM12001
(A.baumannii CCARM12001에 대한 LB-ECL04 농도별 항균활성)

Decrease in bacterial viability after the addition of LB-ECL04(1.0µM) at different temperature.
(다른 시간대에서 LB-ECL04 (1.0 µ M) 첨가 후 세균 생존율 감소)

Decrease in bacterial viability after the addition of LB-ECL04(1.0µM) at different temperature.
(다른 시간대에서 LB-ECL04 (1.0 µ M) 첨가 후 세균 생존율 감소)
↓
Negative control(음성 대조군): 개발물질 미처리로 세균 생존
개발물질 처리시 60도 이상에도 세균 사멸
→ 사람의 체온은 약 36.5도로 주사제 개발에 문제 없음

Antibacterial activities of different concentrations of NaCl(100, 200, 300, 400, 500 or 1,000mM) against A. baumannii CCARM12001
(A. baumannii CCARM12001에 대한 다양한 농도의 NaCl의 항균 활성)
↓
소금의 양이 고농도인 경우에는 개발 물질이 변형되어 세균 증식하나, 인체의 소금농도는 300보다 한참 저농도임
Minimum inhibitory concentrations and minimum bactericidal concentrations
of LB-ECL04 against E. coli strains and A. baumannii strains
(대장균 균주와 아시네토박터 바우만니 균주에 대한 LB-ECL04의 최소억제농도 및 최소살균농도)



③ 그람 음성균 치료제 R&D 세부 일정 (A. baumannii)


| Product Name | LB-ECL04 |
| Product Source | E.coli expression system |
| Biological Activity |
|
| MIC | < 10 ug/ml |
| Purity | Peak % area > 98.0% by SEC-HPLC |
| Endotoxin | Endotoxinlevel is < 1EU/mg |
| IP | 특허 등록 2건 이상 |
시장 규모
AMR(Antibiotic microbial resistance, 항생제 내성) 항생제 시장
*출처: InsightAce Analytic, 2022 |
|
<전세계 AMR항생제 시장 규모 및 전망>
*출처: InsightAce Analytic, 2022 |
<참고1> AMR 감염증 병원 내 감염 유형 사례


<참고2> 미국 내 AMR 감염증 환자 발생 사례


파이프라인의 적응증별 전세계 시장규모 및 전망
① eLBPs


② 엔도라이신


수익모델
국내 외 사업화 전략
(스타트업으로서) 기초연구부터 의약품 승인까지 모든 과정을 진행하는 전통적인 제약 기업과 달리 비임상 단계부터 국내 제약사 또는 글로벌 빅파마로의 기술이전을 통해 수익 창출

CASH COW 확보 전략
사업구조가 취약한 R&D 회사의 한계를 넘기 위해
❶ 인체용 신규 항생제 개발과 더불어 빠른 시장 진입이 가능한 가축대상 항생제 대체제 개발 및 사업화
❷ 보조사료(미생물제), 유기태강사 플랫폼 기반 기능성 화장품 등의 개발 및 사업화 진행

가축 대상 의약품(항생제 대체제), 생균제 사업화, 인체용 의약품 대비 빠른 시간 내에 개발 및 사업화 가능
❶ eLBP 플랫폼 기술 기반 다양한 세균성 질환에 대한 제품 다각화
(예, 가금티푸스, 대장균증등)
❷ 기 보유 중인 유익균, 유기태 생산기술 적극 활용
❸ 단기간 내에 제조 및 유통·판매망 구축 가능
<참고> 캐시카우를 위한 MOU 체결

사업 성과
원천 기술에 대한 특허 보호, 파이프라인별 지식재산권 확보로 높은 진입장벽 구축
① 특허 등록
| 특허명 | 권리권자 (출원인) |
등록일 (출원일) |
적용제품 |
|---|---|---|---|
| 신규 재조합 엔도라이신 및 이의 용도 | (주)리신바이오 | ‘22.07 | 엔도라이신 |
| 박테리오파지 유래 신규 재조합 엔도라이신 및 이의 용도 | (주)리신바이오 | ‘22.07 | 엔도라이신 |
| 엔도라이신을 생산하는 형질전환 바실러스서브틸리스균주 | (주)리신바이오 | ‘22.11 | eLBPs |
② 도입
| 특허명 | 권리권자 (출원인) |
등록일 (출원일) |
적용제품 |
|---|---|---|---|
| 호랑나비 유충에서 분리한 항균펩타이드 유전자 및 항균펩타이드 | 한국농업기술원 | ‘22.11 | 기 타 |
③ PCT 출원
| 특허명 | 권리권자 (출원인) |
등록일 (출원일) |
적용제품 |
|---|---|---|---|
| Transformed Bacillus subtilisstrains producing endolysin | (주)리신바이오 | ‘23.09 | eLBPs |
④ 출원
| 특허명 | 권리권자 (출원인) |
등록일 (출원일) |
적용제품 |
|---|---|---|---|
| 가금티푸스 특이적 재조합 엔도라이신 및 이의 용도 | (주)리신바이오 | ‘23.01 | eLBPs |
| 병원성 그람 음성균저해용 재조합 엔도라이신 및 이의 용도 | (주)리신바이오 | ‘23.10 | 엔도라이신 |

국책과제 선정(TIPS)
① 과제 개요
|
|
② 내용
- 당사는 항생제 내성을 나타내는 타겟하는 그람 양성균 및 음성균 감염증 치료를 위한 박테리오파지 유래 고활성 재조합 리신단백질을 개발 중에 있으며 본 팁스과제 프로그램을 통해서 프로바이오틱스균주를 활용한 리신단백질의 ‘세포 표면 발현 기술’ 및 ‘세포외분비 발현 기술’ 확립을 통해 가축(닭) 사업에서 가장 큰 문제를 일으키는 가금티푸스 원인균인 S. gallinarum을 사멸시킬 수 있는 경구용 치료제를 개발하고
- 리신단백질을 장내에서 유익한 활동을 하는 프로바이오틱스(probiotics) 균주의 표면에 display 하거나 혹은 분비할 수 있게 제작하는 기술이며 최종 제작된 재조합 균주를 직접 경구로 투여할 수 있는 약물로 개발하고자 하는 것임. 이는 가축 및 인간의 장내 세균성 감염을 직접적으로 치료할 수 있는 living medicine으로서 국내는 물론 세계 최초 개발임
국책과제 선정(BIG3)
① 과제 개요
|
|
② 내용
- 장출혈성 대장균을 비롯하여 장내에 문제를 일으키는 병원성 세균을 처치하기 위해 기존의 항생제를 처방할 경우 문제의 병원균 외에 인체에 유익한 세균까지 죽이는 문제를 갖고 있음. 하지만 당사의 박테리오파지 유래 리신단백질의 경우 타겟하는 세균만을 선택적으로 사멸시킬 수 있는 장점 및 차별성을 갖고 있음
- 또한 당사가 개발하고자 하는 장출혈성 대장균 처치용 치료제의 경우 경구용으로 개발을 목표하고 있음. 기존 단백질 의약품들이 경구용으로 개발이 어려웠던 단점을 극복하기 위해 당사 연구진은 ①미생물 세포 표면에 장출혈성 대장균 처치용 리신단백질을 노출시키는 전략과 ② 미생물 세포 밖으로 배출시킬 수 있는 2가지 전략을 통해 재조합 미생물(치료제)을 경구로 투여 됐을 때 세포 외로 충분히 노출되거나 혹은 배출됐을 때 리신단백질이 타겟하는 균주를 직접적으로 처치할 수 있도록 개발함
- 본 사업을 통해 단순히 장출혈성 대장균 감염증을 치료하기 위한 하나의 기술이 아닌 장내에 문제를 일으키는 다양한 원인균 처치를 위한 경구용 치료제 개발과 더불어 염증성 장질환(크론병, 궤양성대장염), 자가면역질환, 바이러스, 백신개발 등 다양한 치료제 개발을 위한 platform 기술로 활용될 수 있음
국책과제 선정(TIPS 창업사업화)
① 과제 개요
|
|
② 내용
- 당사는 항생제 내성을 나타내는 타겟하는 그람 양성균 및 음성균 감염증 치료를 위한 박테리오파지 유래 고활성 재조합 리신단백질을 개발 중에 있으며 본 팁스과제 프로그램을 통해서 프로바이오틱스균주를 활용한 리신단백질의 ‘세포 표면 발현 기술’ 및 ‘세포외분비 발현 기술’ 확립을 통해 가축(닭) 사업에서 가장 큰 문제를 일으키는 가금티푸스 원인균인 S. gallinarum을 사멸시킬 수 있는 경구용 치료제를 개발하고
- 리신단백질을 장내에서 유익한 활동을 하는 프로바이오틱스(probiotics) 균주의 표면에 display 하거나 혹은 분비할 수 있게 제작하는 기술이며 최종 제작된 재조합 균주를 직접 경구로 투여할 수 있는 약물로 개발하고자 하는 것임. 이는 가축 및 인간의 장내 세균성 감염을 직접적으로 치료할 수 있는 living medicine으로서 국내는 물론 세계 최초 개발임
국책과제 선정
① 과제 개요
|
|
② 내용
- 당사가 진행하고 있는 연구에 있어 반드시 필요한 국유특허(농촌진흥청 보유)에 대한 기술사용을 위한 기술 도입 등에 사용할 계획임
- 또한 당 사업기간 내 연구 개발 결과가 나오는 대로 복수의 특허를 출원할 예정이며 L/O와 관련된 중요 특허 출원과 해당 특허 등록 시 일부 특허를 특정하여 본 지원 사업과 연계하여 IP를 획득하였음을 대내외 홍보할 계획임
기타 성과


향후 사업 진행 계획
|
❶ 다양한 치료 분야로 확장 가능한 단백질 신약 DDS 플랫폼 eLBPs 적응증 확장 및 ❷ 지식재산권 추가 확보 |

향후 5개년 추정 손익
손익계산서

[기업가치 산정 근거]
㈜리신바이오의 현재 기업가치(Pre-money Valuation)는 8,120,917,000원으로 결정하였습니다. 1주당 발행가격(7,000원)의 경우 2023.6월 중소벤처기업진흥공단으로부터 투자받은 상환전환우선주 조건과 동일합니다. 이는 아래 유사업체 2개사(비상장사)의 추정 기업가치를 감안하면 적정한 투자가치라 판단합니다.
① 다제내성균 치료제 기업, ㈜마******** : ‘22.3월 기준 55억(Pre 시리즈B) 투자유치 성공 후 추정 기업가치 300억 원
② 박테리오파지 전문기업, ㈜라*** : ’21.12월 기준 100억(시리즈A) 투자유치 성공 후 추정 기업가치 400억 원
(※ 추정재무제표는 첨부파일 '발행인게재자료' 중 52페이지 참조)
수익산출근거
기술 이전을 위한 파이프라인의 적응증별 수익 모델 산출 근거

• eLBPs 치료제의 기술 이전은 eLBPs의 인허가가 상대적으로 용이한 해외기업을 대상으로 접촉
• 2018년, 인트론바이오-스위스 로이반트 간 SAL200(엔도라이신) 기술이전 계약 시 최대 마일스톤은 1조원, 계약금(Upfront)은 1,000만달러임
EXIT 전략
|
|
APPENDIX
연혁


오피스 전경

(2024.05.03 펀딩포유측 현장 방문)
투자위험요소
자금사용목적
리워드 혜택
| 구 분 | 리워드 내용 |
|---|---|
|
오픈 첫날 투자 (금액별 리워드와 별개) |
|
|
사전예약하고 투자 (금액별 리워드와 별개) |
|
|
72 ~ 142주 투자 (504,000원 ~ 994,000원) |
|
|
143 ~ 428주 투자 (1,001,000원 ~ 2,996,000원) |
|
|
429 ~ 714주 투자 (3,003,000원 ~ 4,998,000원) |
|
|
715 ~ 1428주 투자 (5,005,000원 ~ 9,996,000원) |
|
|
1429 ~ 2857주 투자 (10,003,000원 ~ 19,999,000원) |
|
|
2858주 이상 투자 (20,006,000원 이상) |
|
|
※ 펀딩포유 포인트몰은 다양한 상품을 할인된 가격으로 구매할 수 있는 펀딩포유 투자자를 위한 멤버십 서비스입니다. |
|
(주)펀딩포유는 「자본시장과 금융투자업에 관한 법률」제117조의4에 따라 등록승인된 온라인소액투자중개업자입니다.
(주)펀딩포유는 플랫폼 제공자로 자금을 모집하는 당사자가 아닙니다. 따라서 투자 손실의 위험을 보전하거나 리워드 제공을 보장해 드리지 않으며 이에 대한 법적인 책임을 지지 않습니다.
Copyright © 2019 funding4u. All rights reserved.














































